よむ、つかう、まなぶ。
参考資料14 定期の予防接種等による副反応疑いの報告等の取扱いについて(平成25年3月30日付け健発0330第3号・薬食発0330第1号厚生労働省健康局長及び医薬食品局長連名通知。最終改正:令和4年10月24日) (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00059.html |
| 出典情報 | 第92回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第27回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(3/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
報告先:(独)医薬品医療機器総合機構
新型コロナワクチン専用FAX番号:0120-011-126
その他ワクチン用FAX番号:0120-176-146
(別紙様式1)
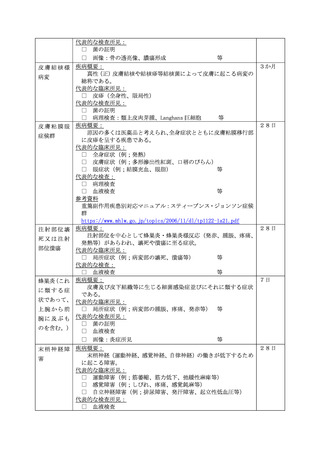
予防接種後副反応疑い報告書
予防接種法上の定期接種・臨時接種、任意接種の別
患
者
(被接種者)
氏名又は
イニシャル
(姓・名)
住
所
氏
名
性別
1 男
接種時
年齢
2 女
都 道
府 県
T H
生年月日 S R
区 市
町 村
2 接種者 (医師以外 )
3 主治医
歳
年
月
月
日生
4 その他(
)
電話番号
医療機関名
住
□任意接種
(定期・臨時の場合は氏名、任意の場合はイニシャルを記載)
1 接種者 (医師)
報 告 者
□定期接種・臨時接種
フリガナ
所
医療機関名
接種場所
住
所
ワクチンの種類
ロット番号
(②~④は、同時接種したものを記載)
ワクチン
接種の状況
製造販売業者名
接種回数
①
① 第
期(
回目)
②
② 第
期(
回目)
③
③ 第
期(
回目)
④
④ 第
期(
回目)
接 種 日
平成・令和
接種前の体温
度
年
月
分
日 午前 ・ 午後
時
分
出生体重
グラム
(患者が乳幼児の場合に記載)
家族歴
予診票での留意点(基礎疾患、アレルギー、最近1ヶ月以内のワクチン接種や病気、服薬中の薬、過去の副作用歴、発育状況等)
1 有
2 無
症 状
定期接種・臨時接種の場合で次頁の報告基準に該当する場合は、ワクチンごとに該当する症状に○をしてください。
急性散在性脳脊髄炎、ギラン・バレ症候群、血栓症(血栓塞栓症を含む。)(血小板減少症を伴うものに限る。)、心筋炎又は
心膜炎に該当する場合は、各調査票を記入のうえ、提出してください。
報告基準にない症状の場合又は任意接種の場合(症状名:
発生日時
本剤との
因果関係
平成・令和
1 関連あり
年
月
2 関連なし
日
3 評価不能
概要(症状・徴候・臨床経過・診断・検査等)
)
午前 ・ 午後
時
分
他要因(他の 1 有
疾患等)の可
能性の有無 2 無
症 状
の 概 要
○製造販売業者への情報提供 : 1 有
1 死亡
症
状
の 程 度
1 重い
5 入院
2 無
2 障害
3 死亡につながるおそれ
病院名:
4 障害につながるおそれ
医師名:
平成・令和
年
6 上記1~5に準じて重い
月
日 入院 / 平成・令和
年
月
日 退院
7 後世代における先天性の疾病又は異常
2 重くない
症
状
の 転 帰
転帰日
平成・令和
年
1 回復
2 軽快
3 未回復
1 第1報
2 第2報
3 第3報以後
報告者意見
報告回数
月
日
4 後遺症(症状:
)
5 死亡
6 不明
新型コロナワクチン専用FAX番号:0120-011-126
その他ワクチン用FAX番号:0120-176-146
(別紙様式1)
予防接種後副反応疑い報告書
予防接種法上の定期接種・臨時接種、任意接種の別
患
者
(被接種者)
氏名又は
イニシャル
(姓・名)
住
所
氏
名
性別
1 男
接種時
年齢
2 女
都 道
府 県
T H
生年月日 S R
区 市
町 村
2 接種者 (医師以外 )
3 主治医
歳
年
月
月
日生
4 その他(
)
電話番号
医療機関名
住
□任意接種
(定期・臨時の場合は氏名、任意の場合はイニシャルを記載)
1 接種者 (医師)
報 告 者
□定期接種・臨時接種
フリガナ
所
医療機関名
接種場所
住
所
ワクチンの種類
ロット番号
(②~④は、同時接種したものを記載)
ワクチン
接種の状況
製造販売業者名
接種回数
①
① 第
期(
回目)
②
② 第
期(
回目)
③
③ 第
期(
回目)
④
④ 第
期(
回目)
接 種 日
平成・令和
接種前の体温
度
年
月
分
日 午前 ・ 午後
時
分
出生体重
グラム
(患者が乳幼児の場合に記載)
家族歴
予診票での留意点(基礎疾患、アレルギー、最近1ヶ月以内のワクチン接種や病気、服薬中の薬、過去の副作用歴、発育状況等)
1 有
2 無
症 状
定期接種・臨時接種の場合で次頁の報告基準に該当する場合は、ワクチンごとに該当する症状に○をしてください。
急性散在性脳脊髄炎、ギラン・バレ症候群、血栓症(血栓塞栓症を含む。)(血小板減少症を伴うものに限る。)、心筋炎又は
心膜炎に該当する場合は、各調査票を記入のうえ、提出してください。
報告基準にない症状の場合又は任意接種の場合(症状名:
発生日時
本剤との
因果関係
平成・令和
1 関連あり
年
月
2 関連なし
日
3 評価不能
概要(症状・徴候・臨床経過・診断・検査等)
)
午前 ・ 午後
時
分
他要因(他の 1 有
疾患等)の可
能性の有無 2 無
症 状
の 概 要
○製造販売業者への情報提供 : 1 有
1 死亡
症
状
の 程 度
1 重い
5 入院
2 無
2 障害
3 死亡につながるおそれ
病院名:
4 障害につながるおそれ
医師名:
平成・令和
年
6 上記1~5に準じて重い
月
日 入院 / 平成・令和
年
月
日 退院
7 後世代における先天性の疾病又は異常
2 重くない
症
状
の 転 帰
転帰日
平成・令和
年
1 回復
2 軽快
3 未回復
1 第1報
2 第2報
3 第3報以後
報告者意見
報告回数
月
日
4 後遺症(症状:
)
5 死亡
6 不明