よむ、つかう、まなぶ。
費-1-2○業界からの意見陳述 (33 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000182080_00014.html |
| 出典情報 | 中央社会保険医療協議会 費用対効果評価専門部会(第63回 8/2)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
参考資料2
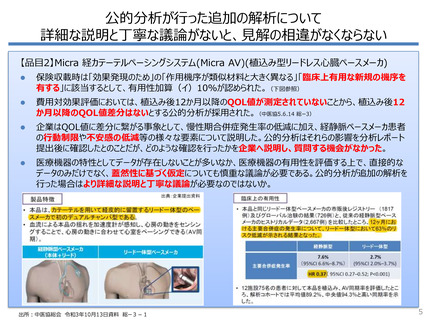
医療機器の薬事承認では臨床試験を求められないことが多い
⚫
「新医療機器」と「改良医療機器(臨床あ
り)」は年38~65品目程度で、年103~
155品目ある新医薬品の半数以下
⚫
「改良医療機器(臨床なし)」と「後発医
療機器」は年323~502品目で、臨床あり
の10倍近い
製品改良が頻回なため、評価対象に選
定されるか分からない品目も含め、費用対
効果分析のために比較試験を実施するこ
とは非現実的
⚫
新規承認品目数
1200
180
160
155
140
131
120
20
0
800
103
65
48
49
43
22
38
36
10
13
59
44
41
18
44
44
33
36
31
27
11
8
13
11
38
805
731
108
600
60
40
126
109
100
80
126
1000
137
502
635
705
483
497
351
329
344
151
154
153
485
620
638
461
466
332
283
273
277299
153
178
193
138
200
0
415
323
400
285
164
159
H27年度 H28年度 H29年度 H30年度 R1年度 R2年度 R3年度 R4年度
H27年度 H28年度 H29年度 H30年度 R1年度 R2年度 R3年度 R4年度
(2015) (2016) (2017) (2018) (2019) (2020) (2021) (2022)
(2015) (2016) (2017) (2018) (2019) (2020) (2021) (2022)
新医療機器
改良医療機器
新医薬品
(臨床あり)
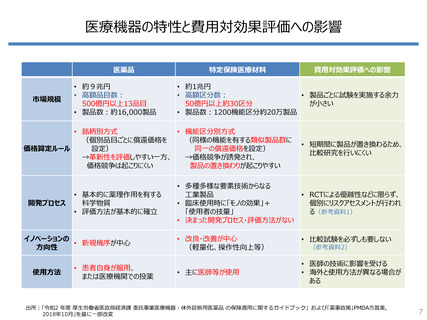
出所: PMDA 業務実績報告書(令和元年度、令和4年度)数値データ集
改良医療機器
後発医療機器
後発医療用医薬品
(臨床なし)
33
医療機器の薬事承認では臨床試験を求められないことが多い
⚫
「新医療機器」と「改良医療機器(臨床あ
り)」は年38~65品目程度で、年103~
155品目ある新医薬品の半数以下
⚫
「改良医療機器(臨床なし)」と「後発医
療機器」は年323~502品目で、臨床あり
の10倍近い
製品改良が頻回なため、評価対象に選
定されるか分からない品目も含め、費用対
効果分析のために比較試験を実施するこ
とは非現実的
⚫
新規承認品目数
1200
180
160
155
140
131
120
20
0
800
103
65
48
49
43
22
38
36
10
13
59
44
41
18
44
44
33
36
31
27
11
8
13
11
38
805
731
108
600
60
40
126
109
100
80
126
1000
137
502
635
705
483
497
351
329
344
151
154
153
485
620
638
461
466
332
283
273
277299
153
178
193
138
200
0
415
323
400
285
164
159
H27年度 H28年度 H29年度 H30年度 R1年度 R2年度 R3年度 R4年度
H27年度 H28年度 H29年度 H30年度 R1年度 R2年度 R3年度 R4年度
(2015) (2016) (2017) (2018) (2019) (2020) (2021) (2022)
(2015) (2016) (2017) (2018) (2019) (2020) (2021) (2022)
新医療機器
改良医療機器
新医薬品
(臨床あり)
出所: PMDA 業務実績報告書(令和元年度、令和4年度)数値データ集
改良医療機器
後発医療機器
後発医療用医薬品
(臨床なし)
33