よむ、つかう、まなぶ。
05 資料 1-3 KMバイオロジクス提出資料[1.8MB] (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34803.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会 予防接種基本方針部会 ワクチン評価に関する小委員会(第20回 8/29)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
クイントバック水性懸濁注射用 国内第III相臨床試験(370P3試験)
試験概要
国内第Ⅲ相試験は、現行の定期接種で使用されているワクチンに対してクイントバック水性懸濁注射用の
免疫原性が劣らないことを検証するために、HibワクチンとDPT-IPVの同時接種を対照とした多施設共同評価者
盲検ランダム化並行群間比較試験にて実施した。
試験の目的
免疫原性の検証、安全性の検討
試験デザイン
多施設共同評価者盲検ランダム化並行群間比較試験
対象
評価症例数
生後2か月以上60か月未満の乳幼児
有効性解析対象例:逸脱例を除く492例_FAS (本剤群245例、対照薬群247例)
安全性解析対象例:496例(本剤群247例、対照薬群249例)
接種群(治験薬)
本剤群(クイントバック群):クイントバック水性懸濁注射用
対照薬群(Hib+DPT-IPV群) :Hibワクチン(アクトヒブ)+DPT-IPV(クアトロバック皮下注シリンジ)
用法・用量
1回0.5mL、20日から56日までの間隔をおいて3回(初回免疫)、3回目接種後6か月以上18か月未
満の間隔をおいて1回(追加免疫)、計4回皮下接種した。(Hib+DPT-IPV群は同時接種)
他のワクチンとの
同時接種
可(治験薬接種当日から接種6日後までは、治験薬以外のワクチン・トキソイドの接種を禁止した)
評価項目
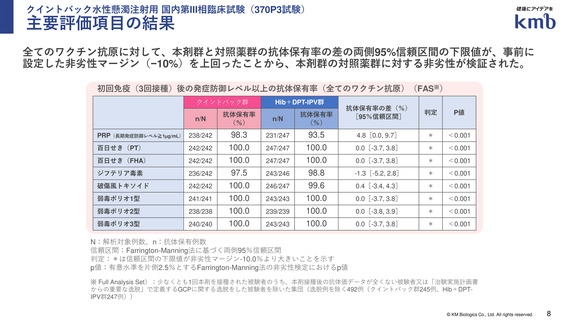
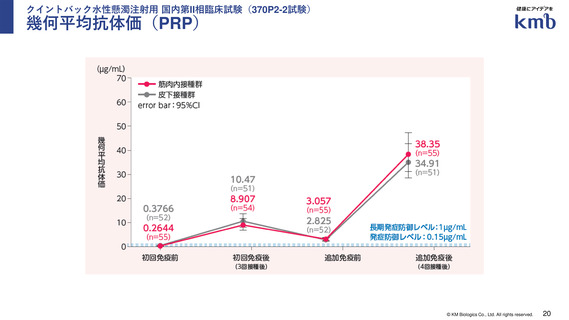
有効性:発症防御レベル以上の抗体保有率、幾何平均抗体価
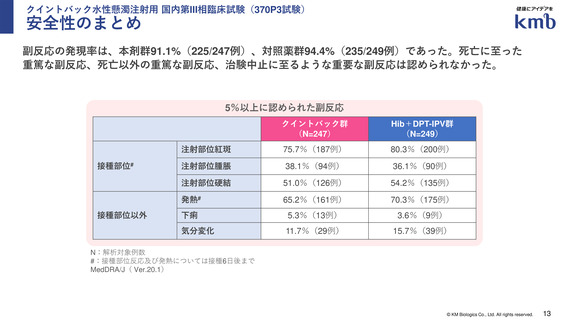
安全性:有害事象
© KM Biologics Co., Ltd. All rights reserved.
5
試験概要
国内第Ⅲ相試験は、現行の定期接種で使用されているワクチンに対してクイントバック水性懸濁注射用の
免疫原性が劣らないことを検証するために、HibワクチンとDPT-IPVの同時接種を対照とした多施設共同評価者
盲検ランダム化並行群間比較試験にて実施した。
試験の目的
免疫原性の検証、安全性の検討
試験デザイン
多施設共同評価者盲検ランダム化並行群間比較試験
対象
評価症例数
生後2か月以上60か月未満の乳幼児
有効性解析対象例:逸脱例を除く492例_FAS (本剤群245例、対照薬群247例)
安全性解析対象例:496例(本剤群247例、対照薬群249例)
接種群(治験薬)
本剤群(クイントバック群):クイントバック水性懸濁注射用
対照薬群(Hib+DPT-IPV群) :Hibワクチン(アクトヒブ)+DPT-IPV(クアトロバック皮下注シリンジ)
用法・用量
1回0.5mL、20日から56日までの間隔をおいて3回(初回免疫)、3回目接種後6か月以上18か月未
満の間隔をおいて1回(追加免疫)、計4回皮下接種した。(Hib+DPT-IPV群は同時接種)
他のワクチンとの
同時接種
可(治験薬接種当日から接種6日後までは、治験薬以外のワクチン・トキソイドの接種を禁止した)
評価項目
有効性:発症防御レベル以上の抗体保有率、幾何平均抗体価
安全性:有害事象
© KM Biologics Co., Ltd. All rights reserved.
5