よむ、つかう、まなぶ。
費ー1○制度見直しに関する検討(その2)について (43 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000182080_00016.html |
| 出典情報 | 中央社会保険医療協議会 費用対効果評価専門部会(第65回 10/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
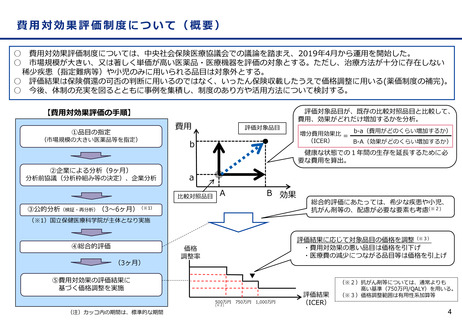
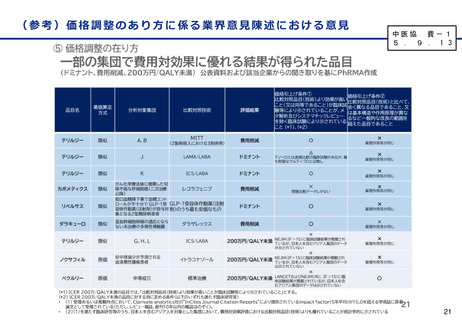
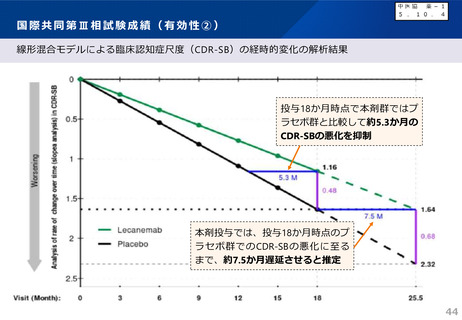
国際共同第Ⅲ相試験成績(有効性①)
全体の結果
※有効性評価例数:1,734例(プラセボ群875例、本剤群859例)
うち日本人151例(プラセボ群64例、本剤群87例)
⚫ 主要評価項目:ベースラインから治験薬
投与後18カ月時点までの臨床認知症尺
度(CDR-SB)の変化量
✓ 18か月(79週)時点のCDR-SBのスコア
の悪化速度は、プラセボ群に対し本剤群で
は27.1%抑制(CDR-SBの悪化抑制効
果について 本剤 群のプラセボ群に対する優
越性あり)
✓ CDR-SBのベースラインからの変化量につい
て、本剤群とプラセボ群の群間差は
-0.45であり、CDR-SBの悪化抑制効果
について本剤群のプラセボ群に対する優越
性が示された。
✓ なお、本試験により、アルツハイマー病による
軽度認知障害(MCI)からのアルツハイ
マー病による認知症への進行や軽度アルツ
ハイマー病による認知症から中等度以上へ
の進行が本剤投与により抑制されることも示
唆。
※ CDR は6つの項目(記憶、見当識 、判断力と問題解決能力、地域社会の活動、家庭及び趣味、身の回りの世話)それぞれの程度について、0(なし)、
0.5(疑わしい)、1(軽度)、2(中等度)、3(重度)の5段階で示す臨床評価指標であり、各項目のスコアの合計がCDR-SBとして算出される。
本剤の臨床試験では、本剤群とプラセボ群のCDR-SBのベースラインからの変化量の群間差が-0.373を絶対値で上回った場合に、臨床的意義があると
事前に想定された。
43
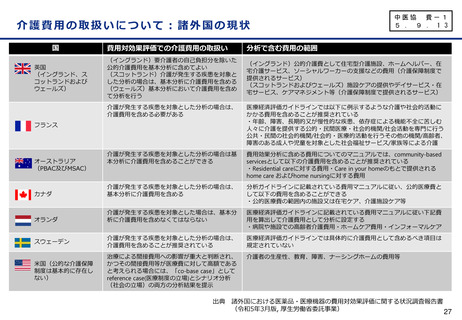
全体の結果
※有効性評価例数:1,734例(プラセボ群875例、本剤群859例)
うち日本人151例(プラセボ群64例、本剤群87例)
⚫ 主要評価項目:ベースラインから治験薬
投与後18カ月時点までの臨床認知症尺
度(CDR-SB)の変化量
✓ 18か月(79週)時点のCDR-SBのスコア
の悪化速度は、プラセボ群に対し本剤群で
は27.1%抑制(CDR-SBの悪化抑制効
果について 本剤 群のプラセボ群に対する優
越性あり)
✓ CDR-SBのベースラインからの変化量につい
て、本剤群とプラセボ群の群間差は
-0.45であり、CDR-SBの悪化抑制効果
について本剤群のプラセボ群に対する優越
性が示された。
✓ なお、本試験により、アルツハイマー病による
軽度認知障害(MCI)からのアルツハイ
マー病による認知症への進行や軽度アルツ
ハイマー病による認知症から中等度以上へ
の進行が本剤投与により抑制されることも示
唆。
※ CDR は6つの項目(記憶、見当識 、判断力と問題解決能力、地域社会の活動、家庭及び趣味、身の回りの世話)それぞれの程度について、0(なし)、
0.5(疑わしい)、1(軽度)、2(中等度)、3(重度)の5段階で示す臨床評価指標であり、各項目のスコアの合計がCDR-SBとして算出される。
本剤の臨床試験では、本剤群とプラセボ群のCDR-SBのベースラインからの変化量の群間差が-0.373を絶対値で上回った場合に、臨床的意義があると
事前に想定された。
43