よむ、つかう、まなぶ。
資料1-2 日本パブリックアフェアーズ協会 御提出資料 (11 ページ)
出典
| 公開元URL | https://www8.cao.go.jp/kisei-kaikaku/kisei/meeting/wg/2310_04medical/240328/medical09_agenda.html |
| 出典情報 | 規制改革推進会議 健康・医療・介護ワーキング・グループ(第9回 3/28)《内閣府》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
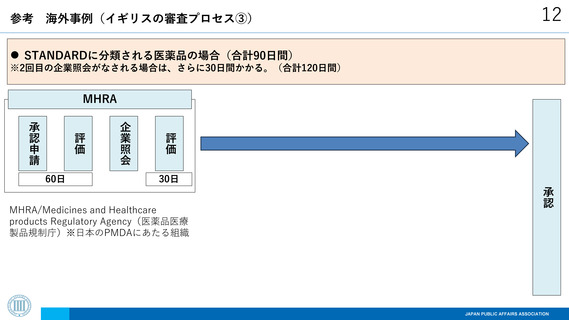
参考
10
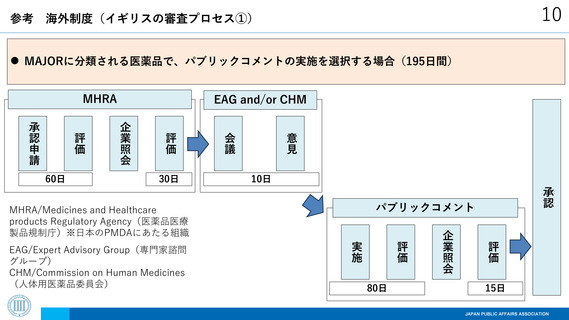
海外制度(イギリスの審査プロセス①)
MAJORに分類される医薬品で、パブリックコメントの実施を選択する場合(195日間)
MHRA
承認
パブリックコメント
評価
企業照会
80日
評価
EAG/Expert Advisory Group(専門家諮問
グループ)
CHM/Commission on Human Medicines
(人体用医薬品委員会)
10日
実施
MHRA/Medicines and Healthcare
products Regulatory Agency(医薬品医療
製品規制庁)※日本のPMDAにあたる組織
意見
30日
会議
評価
企業照会
評価
承認申請
60日
EAG and/or CHM
15日
JAPAN PUBLIC AFFAIRS ASSOCIATION
10
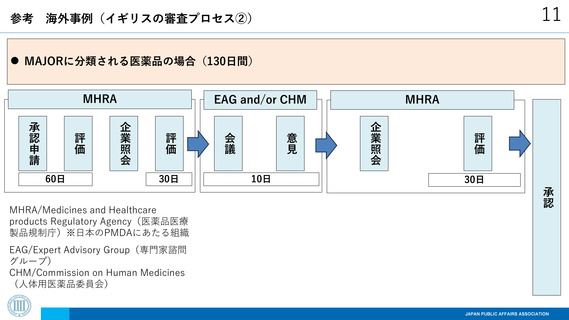
海外制度(イギリスの審査プロセス①)
MAJORに分類される医薬品で、パブリックコメントの実施を選択する場合(195日間)
MHRA
承認
パブリックコメント
評価
企業照会
80日
評価
EAG/Expert Advisory Group(専門家諮問
グループ)
CHM/Commission on Human Medicines
(人体用医薬品委員会)
10日
実施
MHRA/Medicines and Healthcare
products Regulatory Agency(医薬品医療
製品規制庁)※日本のPMDAにあたる組織
意見
30日
会議
評価
企業照会
評価
承認申請
60日
EAG and/or CHM
15日
JAPAN PUBLIC AFFAIRS ASSOCIATION