よむ、つかう、まなぶ。
資料1-2 精製ヒアルロン酸ナトリウムのリスク 区分について[5.0MB] (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_39892.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和6年度第2回 4/30)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
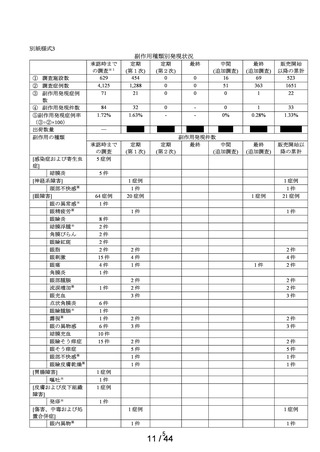
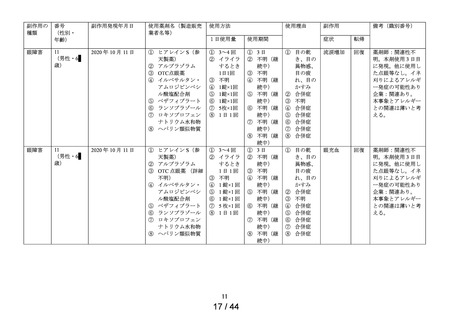
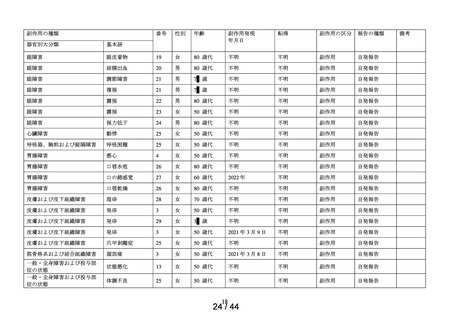
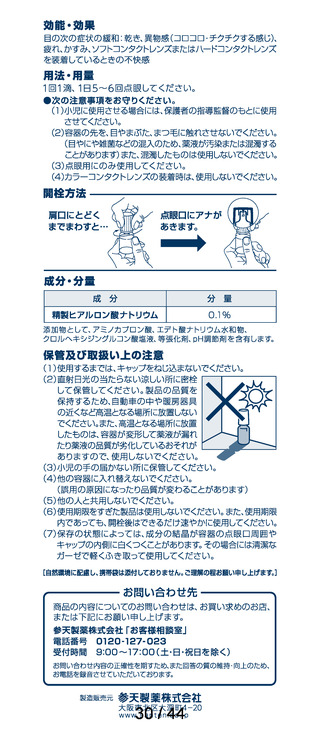
[製品の問題]
医療機器色調
の問題※
1 症例
1件
1 症例
1件
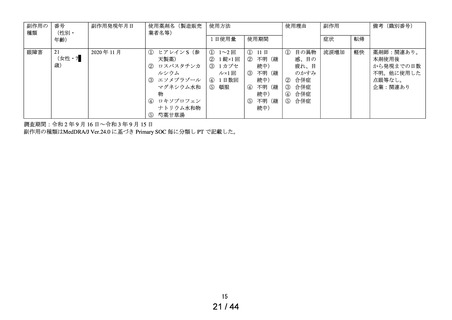
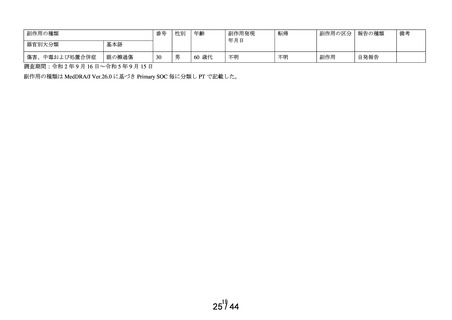
第1次の定期報告における副作用の用語は、MedDRA/J Ver.24.0を使用し、最終報告(追加調査)における
副作用の用語はMedDRA/J Ver.26.0を使用した。器官別大分類 (SOC) は症例数、基本語 (PT) は件数で集計
した。
※1:医療用「ヒアレイン点眼液0.1%」、「ヒアレインミニ点眼液0.1%」及び「ヒアレインミニ点眼液
0.3%」の承認時までの調査、及び承認時以降の調査を合算したもの。調査当時の副作用の用語を報告書作
成時のMedDRA用語に置き換えて使用した。
※:使用上の注意から予測できない副作用・感染症
副作用頻度調査期間
定期(第1次) :令和 2 年 9 月 16 日~令和 3 年 9 月 15 日
定期(第2次) :令和 3 年 9 月 16 日~令和 4 年 9 月 15 日
最終
:令和 4 年 9 月 16 日~令和 5 年 9 月 15 日
中間(追加調査):令和 5 年 3 月 1 日~令和 5 年 3 月 28 日
最終(追加調査):令和 5 年 3 月 1 日~令和 5 年 5 月 30 日
6
12 / 44
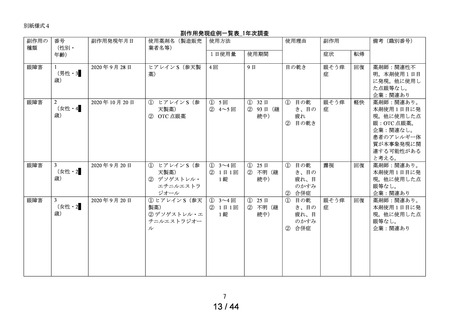
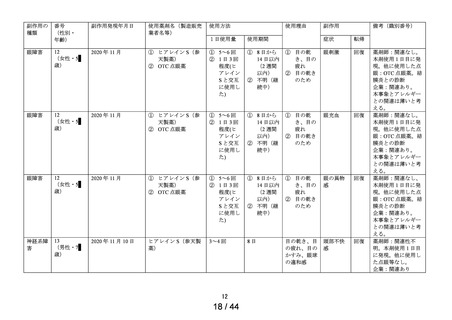
医療機器色調
の問題※
1 症例
1件
1 症例
1件
第1次の定期報告における副作用の用語は、MedDRA/J Ver.24.0を使用し、最終報告(追加調査)における
副作用の用語はMedDRA/J Ver.26.0を使用した。器官別大分類 (SOC) は症例数、基本語 (PT) は件数で集計
した。
※1:医療用「ヒアレイン点眼液0.1%」、「ヒアレインミニ点眼液0.1%」及び「ヒアレインミニ点眼液
0.3%」の承認時までの調査、及び承認時以降の調査を合算したもの。調査当時の副作用の用語を報告書作
成時のMedDRA用語に置き換えて使用した。
※:使用上の注意から予測できない副作用・感染症
副作用頻度調査期間
定期(第1次) :令和 2 年 9 月 16 日~令和 3 年 9 月 15 日
定期(第2次) :令和 3 年 9 月 16 日~令和 4 年 9 月 15 日
最終
:令和 4 年 9 月 16 日~令和 5 年 9 月 15 日
中間(追加調査):令和 5 年 3 月 1 日~令和 5 年 3 月 28 日
最終(追加調査):令和 5 年 3 月 1 日~令和 5 年 5 月 30 日
6
12 / 44