よむ、つかう、まなぶ。
資料1-2 精製ヒアルロン酸ナトリウムのリスク 区分について[5.0MB] (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_39892.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和6年度第2回 4/30)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
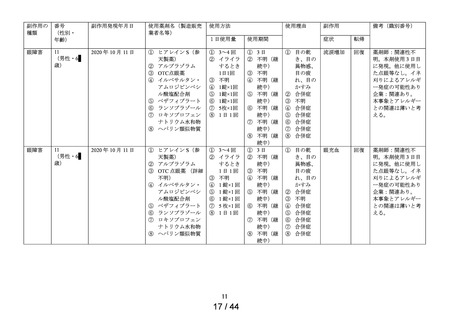
別紙様式2
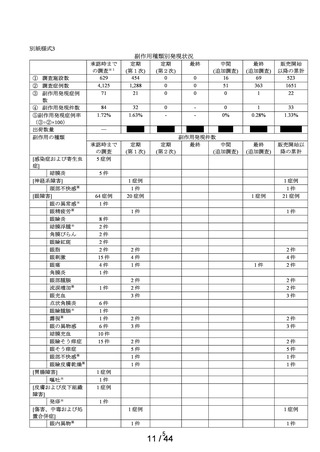
要指導医薬品製造販売後安全性調査報告書
承認番号・
① ヒアレインS
販
② サンテ ヒアルロン酸点
名
眼液
売
年月日
① 30200APX00118000・
令和2 年 5 月 8 日
② 30200APX00119000・
令和2 年 5 月 8 日
副作用頻度調査期間
調
査
施
設
数
令和 2 年 9 月 16 日~
令和 5 年 9 月 15 日
出
荷
数
精製ヒアルロン酸ナトリウム
報告年次
最終
調査症例数
1年次 454施設
追加
有効成分名
1年次
1,288 例
追加 363例
69施設
量
調査結果の概要
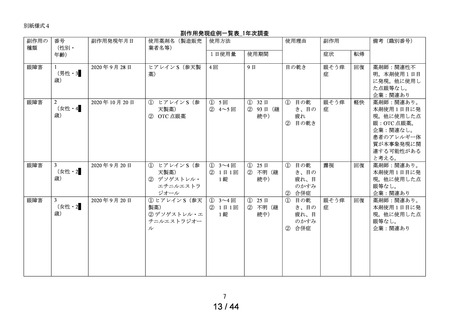
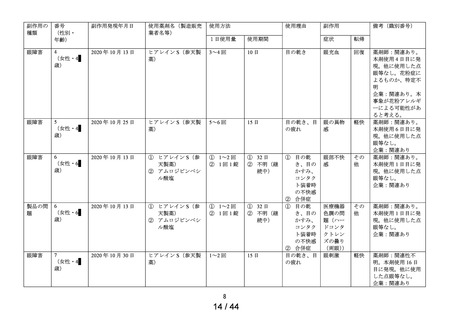
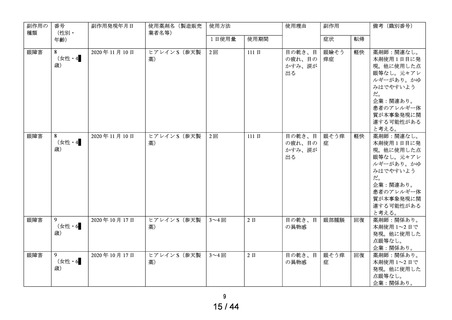
別紙(1)のとおり
副作用種類別発現状況
別紙様式3のとおり
副作用発現症例一覧表
調査結果に対する見解と
今後の安全対策
別紙様式4,5,6のとおり
別紙(2)のとおり
・本剤は参天製薬株式会社が開発し、申請区分(4)(要指導(一般用)新有
効成分含有医薬品)として申請した。
・本剤は精製ヒアルロン酸ナトリウムを含有する医療用医薬品「ヒアレ
備
考
イン点眼液0.1%」と同一の製剤を、要指導・一般用眼科薬として開発し
た製剤である。
・販売開始年月日
ヒアレインS:令和 2 年 9 月 16 日
サンテ ヒアルロン酸点眼液:未発売
・担当者:参天製薬株式会社セイフティーヴィジランス統括部
日本ファーマコエピデミオロジーチーム
連絡先:
TEL:
FAX:
上記により要指導医薬品製造販売後安全性調査の結果を報告します。
令和 5 年 11 月
9日
大阪市北区大深町4-20
参天製薬株式会社
代表取締役社長兼CEO
独立行政法人
医薬品医療機器総合機構理事長 殿
1
7 / 44
伊藤
毅
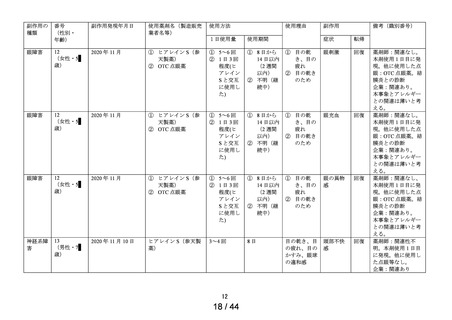
要指導医薬品製造販売後安全性調査報告書
承認番号・
① ヒアレインS
販
② サンテ ヒアルロン酸点
名
眼液
売
年月日
① 30200APX00118000・
令和2 年 5 月 8 日
② 30200APX00119000・
令和2 年 5 月 8 日
副作用頻度調査期間
調
査
施
設
数
令和 2 年 9 月 16 日~
令和 5 年 9 月 15 日
出
荷
数
精製ヒアルロン酸ナトリウム
報告年次
最終
調査症例数
1年次 454施設
追加
有効成分名
1年次
1,288 例
追加 363例
69施設
量
調査結果の概要
別紙(1)のとおり
副作用種類別発現状況
別紙様式3のとおり
副作用発現症例一覧表
調査結果に対する見解と
今後の安全対策
別紙様式4,5,6のとおり
別紙(2)のとおり
・本剤は参天製薬株式会社が開発し、申請区分(4)(要指導(一般用)新有
効成分含有医薬品)として申請した。
・本剤は精製ヒアルロン酸ナトリウムを含有する医療用医薬品「ヒアレ
備
考
イン点眼液0.1%」と同一の製剤を、要指導・一般用眼科薬として開発し
た製剤である。
・販売開始年月日
ヒアレインS:令和 2 年 9 月 16 日
サンテ ヒアルロン酸点眼液:未発売
・担当者:参天製薬株式会社セイフティーヴィジランス統括部
日本ファーマコエピデミオロジーチーム
連絡先:
TEL:
FAX:
上記により要指導医薬品製造販売後安全性調査の結果を報告します。
令和 5 年 11 月
9日
大阪市北区大深町4-20
参天製薬株式会社
代表取締役社長兼CEO
独立行政法人
医薬品医療機器総合機構理事長 殿
1
7 / 44
伊藤
毅