よむ、つかう、まなぶ。
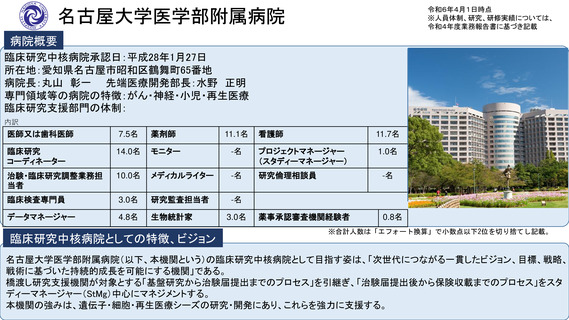
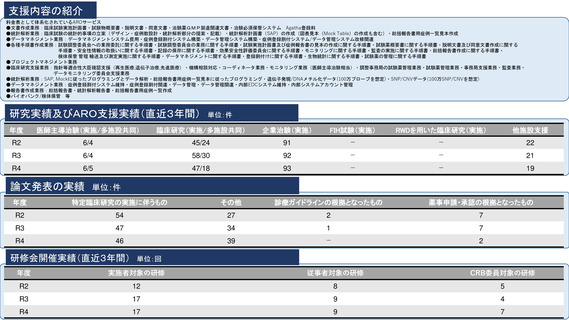
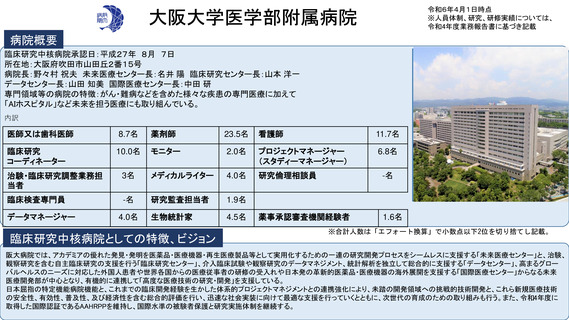
参考資料2:臨床研究中核病院概要 (56 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第35回 8/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
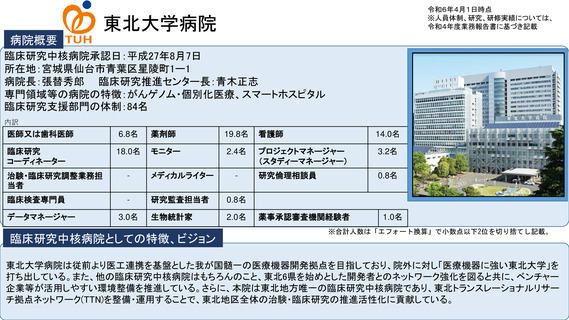
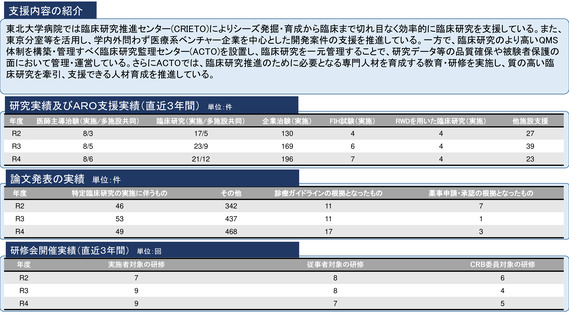
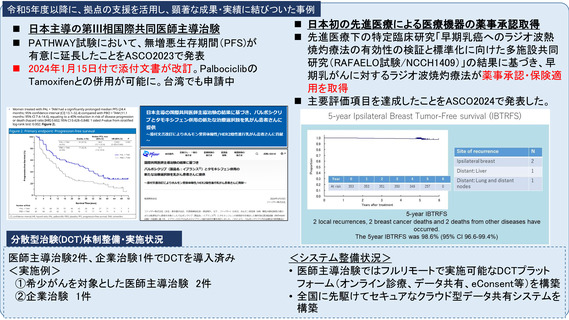
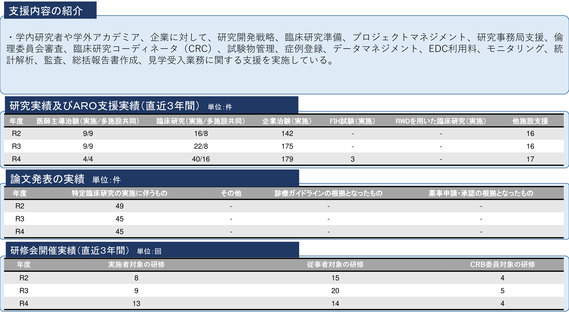
令和5年度以降に、拠点の支援を活用し、顕著な成果・実績に結びついた事例
シーズ名:「BRAF V600変異陽性の進行性神経膠腫を有する小児を対象とした
シーズ名:「手術不能肺野型Ⅰ期非小細胞肺癌に対する重粒子線治療の多施設
特に、自大学内や、他研究機関との連携により、実用化された例、薬事承認につながった例があるようなら挙
ダブラフェニブ・トラメチニブ併用療法に関する患者申出療養」
共同臨床試験(先進医療B)」 代表 九州国際重粒子線がん治療センター
げてください。(例:経済産業学部との連携により、新型医療機器である○○○を実用化した)
代表
九州大学病院 古賀 友紀
末藤 大明
令和5年11月に、タフィンラーカプセル(ダブラフェニブ)およびメキニス
令和6年度診療報酬改定により、重粒子線治療が既存のX線治療等と比較して
※本資料を閲覧した製薬企業やベンチャー企業が、
ト錠(トラメチニブ)の適応として「標準的な治療が困難な
BRAF遺伝子変
生存率等の改善が確認されたとして、重粒子線治療の保険対象疾患に「早期
異を有する進行・再発の固形腫瘍(結腸・直腸癌を除く)」が追加され、体
貴病院と共同研究・臨床研究の相談をしたくなるような研究がありましたらぜひともご紹介ください。
肺癌※(Ⅰ期からⅡA期までの肺癌に限る)」が追加された。
重26kg以上の小児に対する用法及び用量が追加された。
※手術による根治的な治療法が困難であるものに限る。
本申請においてDAB及びTRAの小児患者に対する用法・用量で投与された日本人の
また分散型治験(DCT)を実施されておられましたら、別途記載をお願いいたします。
臨床試験成績を提出していないものの、X2101試験のパートDと同一の用法・用量
でDAB/TRA投与が行われた臨床試験及び患者申出療養における日本人の小児患者
に対するDAB/TRA投与の有効性の結果は表31のとおりであった。(PMDA審査報
告書より抜粋、 図番号も原文通り。)
BRAFV600変異陽性の
進行性神経膠腫を有する
小児を対象とした
ダブラフェニブ・トラメ
チニブ併用療法に関する
患者申出療養
(医療技術評価提案書概要図より抜粋。)
分散型治験(DCT)体制整備・実施状況
<実施>
①精神科領域倫理指針介入研究1件:症例数54例、full DCT
②食品領域倫理指針介入研究1件:症例数120例、full DCT(IRB承認、開始準備
中)
<システム整備状況>
オンライン診療システムMiROHA導入・オンライン診療環境整備
REDCapによるeConsentシステム導入
<運用体制整備状況>
地域連携室を介する地域の訪問看護ステーションとの連携体制整備
トレーニング実施(模擬治験のシナリオ2本と院内での模擬治験による動線確認)
eClinRO/ePROのマニュアル整備
宅配便を用いる治験薬(内服、室温管理)の配送整備
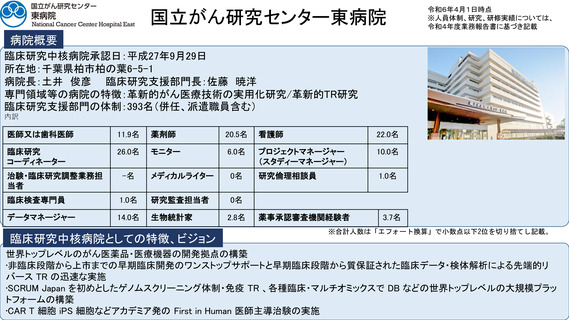
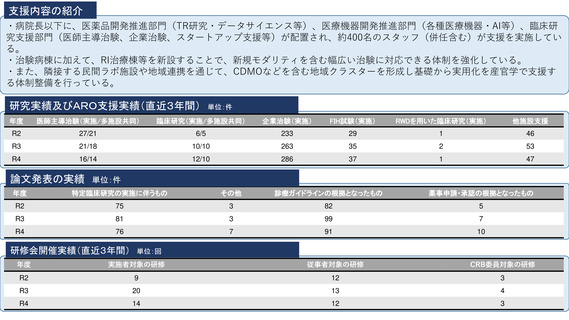
シーズ名:「BRAF V600変異陽性の進行性神経膠腫を有する小児を対象とした
シーズ名:「手術不能肺野型Ⅰ期非小細胞肺癌に対する重粒子線治療の多施設
特に、自大学内や、他研究機関との連携により、実用化された例、薬事承認につながった例があるようなら挙
ダブラフェニブ・トラメチニブ併用療法に関する患者申出療養」
共同臨床試験(先進医療B)」 代表 九州国際重粒子線がん治療センター
げてください。(例:経済産業学部との連携により、新型医療機器である○○○を実用化した)
代表
九州大学病院 古賀 友紀
末藤 大明
令和5年11月に、タフィンラーカプセル(ダブラフェニブ)およびメキニス
令和6年度診療報酬改定により、重粒子線治療が既存のX線治療等と比較して
※本資料を閲覧した製薬企業やベンチャー企業が、
ト錠(トラメチニブ)の適応として「標準的な治療が困難な
BRAF遺伝子変
生存率等の改善が確認されたとして、重粒子線治療の保険対象疾患に「早期
異を有する進行・再発の固形腫瘍(結腸・直腸癌を除く)」が追加され、体
貴病院と共同研究・臨床研究の相談をしたくなるような研究がありましたらぜひともご紹介ください。
肺癌※(Ⅰ期からⅡA期までの肺癌に限る)」が追加された。
重26kg以上の小児に対する用法及び用量が追加された。
※手術による根治的な治療法が困難であるものに限る。
本申請においてDAB及びTRAの小児患者に対する用法・用量で投与された日本人の
また分散型治験(DCT)を実施されておられましたら、別途記載をお願いいたします。
臨床試験成績を提出していないものの、X2101試験のパートDと同一の用法・用量
でDAB/TRA投与が行われた臨床試験及び患者申出療養における日本人の小児患者
に対するDAB/TRA投与の有効性の結果は表31のとおりであった。(PMDA審査報
告書より抜粋、 図番号も原文通り。)
BRAFV600変異陽性の
進行性神経膠腫を有する
小児を対象とした
ダブラフェニブ・トラメ
チニブ併用療法に関する
患者申出療養
(医療技術評価提案書概要図より抜粋。)
分散型治験(DCT)体制整備・実施状況
<実施>
①精神科領域倫理指針介入研究1件:症例数54例、full DCT
②食品領域倫理指針介入研究1件:症例数120例、full DCT(IRB承認、開始準備
中)
<システム整備状況>
オンライン診療システムMiROHA導入・オンライン診療環境整備
REDCapによるeConsentシステム導入
<運用体制整備状況>
地域連携室を介する地域の訪問看護ステーションとの連携体制整備
トレーニング実施(模擬治験のシナリオ2本と院内での模擬治験による動線確認)
eClinRO/ePROのマニュアル整備
宅配便を用いる治験薬(内服、室温管理)の配送整備