よむ、つかう、まなぶ。
参考資料2:臨床研究中核病院概要 (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第35回 8/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
国立がん研究センター東病院
令和6年4月1日時点
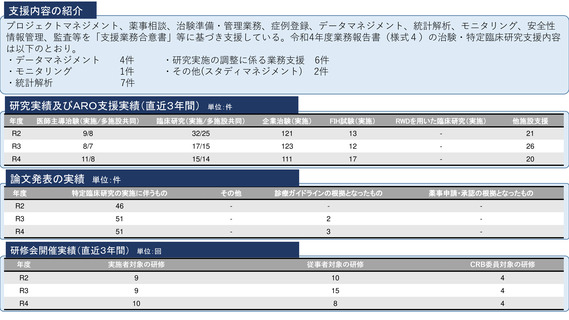
※人員体制、研究、研修実績については、
令和4年度業務報告書に基づき記載
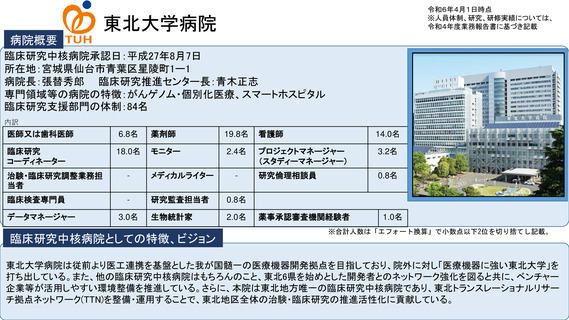
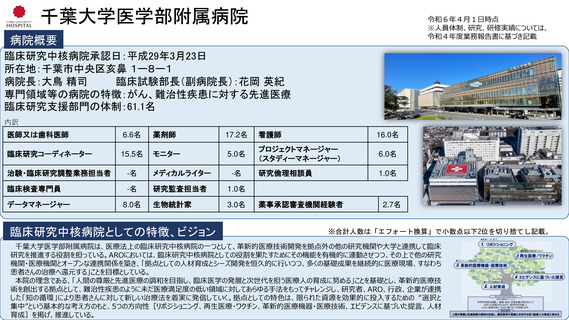
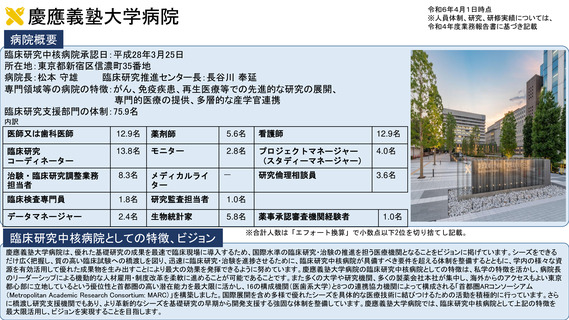
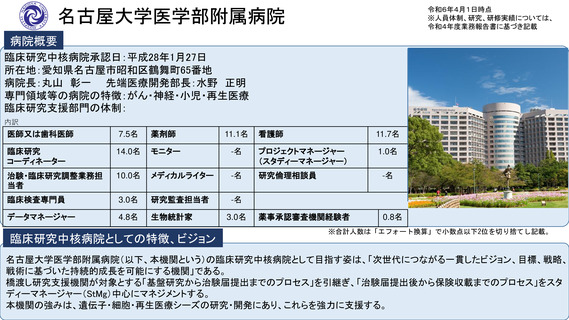
病院概要
臨床研究中核病院承認日:平成27年9月29日
所在地:千葉県柏市柏の葉6-5-1
病院長:土井 俊彦 臨床研究支援部門長:佐藤 暁洋
専門領域等の病院の特徴:革新的がん医療技術の実用化研究/革新的TR研究
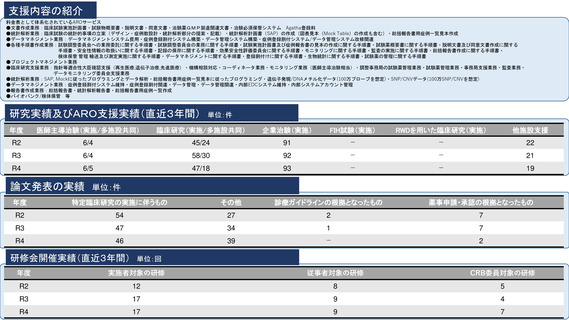
臨床研究支援部門の体制:393名(併任、派遣職員含む)
内訳
医師又は歯科医師
11.9名
薬剤師
20.5名
看護師
22.0名
臨床研究
コーディネーター
26.0名
モニター
6.0名
プロジェクトマネージャー
(スタディーマネージャー)
10.0名
治験・臨床研究調整業務担
当者
-名
メディカルライター
0名
研究倫理相談員
1.0名
臨床検査専門員
1.0名
研究監査担当者
0名
データマネージャー
14.0名
生物統計家
2.8名
薬事承認審査機関経験者
3.7名
臨床研究中核病院としての特徴、ビジョン
※合計人数は「エフォート換算」で小数点以下2位を切り捨てし記載。
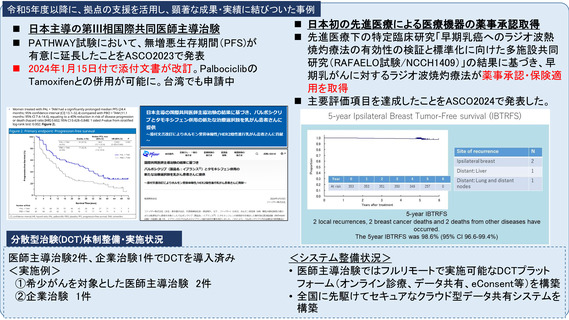
世界トップレベルのがん医薬品・医療機器の開発拠点の構築
•非臨床段階から上市までの早期臨床開発のワンストップサポートと早期臨床段階から質保証された臨床データ・検体解析による先端的リ
バース TR の迅速な実施
•SCRUM Japan を初めとしたゲノムスクリーニング体制・免疫 TR 、各種臨床・マルチオミックスで DB などの世界トップレベルの大規模プラッ
トフォームの構築
•CAR T 細胞 iPS 細胞などアカデミア発の First in Human 医師主導治験の実施
令和6年4月1日時点
※人員体制、研究、研修実績については、
令和4年度業務報告書に基づき記載
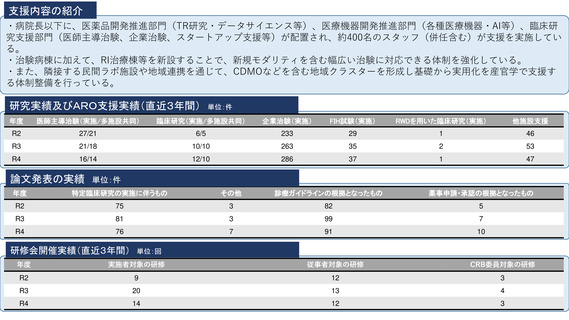
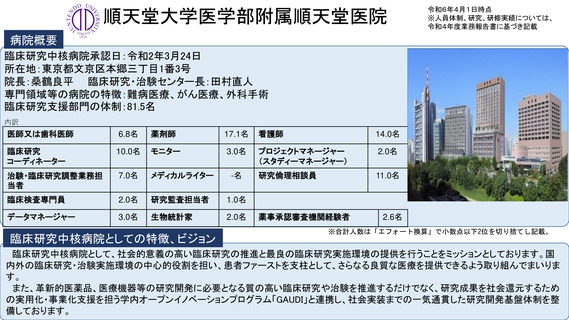
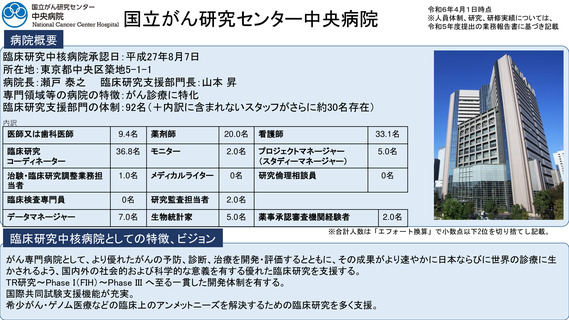
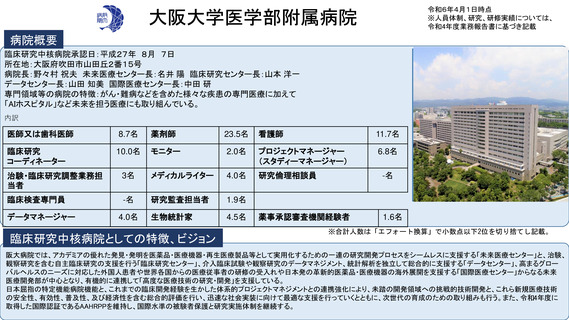
病院概要
臨床研究中核病院承認日:平成27年9月29日
所在地:千葉県柏市柏の葉6-5-1
病院長:土井 俊彦 臨床研究支援部門長:佐藤 暁洋
専門領域等の病院の特徴:革新的がん医療技術の実用化研究/革新的TR研究
臨床研究支援部門の体制:393名(併任、派遣職員含む)
内訳
医師又は歯科医師
11.9名
薬剤師
20.5名
看護師
22.0名
臨床研究
コーディネーター
26.0名
モニター
6.0名
プロジェクトマネージャー
(スタディーマネージャー)
10.0名
治験・臨床研究調整業務担
当者
-名
メディカルライター
0名
研究倫理相談員
1.0名
臨床検査専門員
1.0名
研究監査担当者
0名
データマネージャー
14.0名
生物統計家
2.8名
薬事承認審査機関経験者
3.7名
臨床研究中核病院としての特徴、ビジョン
※合計人数は「エフォート換算」で小数点以下2位を切り捨てし記載。
世界トップレベルのがん医薬品・医療機器の開発拠点の構築
•非臨床段階から上市までの早期臨床開発のワンストップサポートと早期臨床段階から質保証された臨床データ・検体解析による先端的リ
バース TR の迅速な実施
•SCRUM Japan を初めとしたゲノムスクリーニング体制・免疫 TR 、各種臨床・マルチオミックスで DB などの世界トップレベルの大規模プラッ
トフォームの構築
•CAR T 細胞 iPS 細胞などアカデミア発の First in Human 医師主導治験の実施