よむ、つかう、まなぶ。
資料2-6 「医薬品の製造販売後調査等の実施計画の策定に関する検討の進め方について」の一部改正について[977KB] (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44308.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
別添
医薬品の製造販売後調査等の実施計画の策定に関する
検討の進め方について
製造販売後調査等の実施計画は、製造販売後に追加で検討が必要な場合の有
効性に関する調査・試験計画と安全性監視計画から構成される。製造販売後調査
等を実施する場合には、治験等の情報、対象となる疾患、医薬品の特性等を踏ま
え、リサーチ・クエスチョンを明確にした上で、過不足なく適正に実施すること
が重要である。またそれと同時に、目的が不明瞭な調査を漫然と実施することが
ないよう留意し、あらかじめ調査目的及び必要性について十分に検討する必要
がある。ここで示すリサーチ・クエスチョンとは、具体的かつ明確な調査・試験
の課題のことであり、対象集団、主たる検討対象の薬剤、比較対照、対象とする
有効性・安全性検討事項及び対象期間の要素が含まれる。設定された課題に従っ
て、調査・試験デザイン、最終的に評価する指標値及び情報の取得方法等につい
て十分な検討を行う。
一般的に、製造販売承認(以下「承認」という。)に足る有効性に係る情報は、
承認時に評価された治験により収集されており、承認時に有効性に係る一定の
評価がなされている。したがって、承認審査の過程及び製造販売後に、評価すべ
き具体的な検討事項が生じていない場合は、製造販売後の有効性については、製
造販売後調査等によらない、文献の分析等による方法で評価することで差し支
えない。一方、承認審査の過程及び製造販売後に、有効性に関する具体的な検討
事項が生じた場合は、当該事項を科学的に確認することが可能となる製造販売
後調査等を実施する必要がある。
安全性検討事項は、「医薬品リスク管理計画指針について」(平成 24 年4月
11 日付け薬食安発 0411 第1号及び薬食審査発 0411 第2号、厚生労働省医薬食
品局安全対策課長及び審査管理課長連名通知)に基づき設定されるが、安全性監
視計画の具体化については、科学的な観点及び現行の承認審査の過程を考慮す
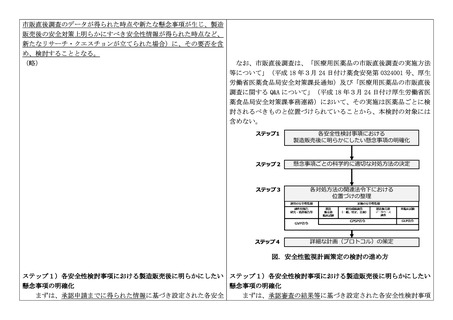
ると、1)各安全性検討事項における製造販売後に明らかにしたい懸念事項の明
確化、2)懸念事項ごとの科学的に適切な対処方法の決定、3)各対処方法の関
連法令下における位置づけの整理、4)詳細な調査計画(プロトコル)の策定、
の大きく4ステップ(図参照)に分けることができ、原則としてステップ3まで
は承認時までに独立行政法人医薬品医療機器総合機構(以下「PMDA」という。)
と申請者間で合意される必要がある。それぞれのステップにおける特徴と留意
点を以下に示す。また、これらの検討にあたっては、下記通知(以下「安全性監
視関連通知」という。)も参照すること。
医薬品の製造販売後調査等の実施計画の策定に関する
検討の進め方について
製造販売後調査等の実施計画は、製造販売後に追加で検討が必要な場合の有
効性に関する調査・試験計画と安全性監視計画から構成される。製造販売後調査
等を実施する場合には、治験等の情報、対象となる疾患、医薬品の特性等を踏ま
え、リサーチ・クエスチョンを明確にした上で、過不足なく適正に実施すること
が重要である。またそれと同時に、目的が不明瞭な調査を漫然と実施することが
ないよう留意し、あらかじめ調査目的及び必要性について十分に検討する必要
がある。ここで示すリサーチ・クエスチョンとは、具体的かつ明確な調査・試験
の課題のことであり、対象集団、主たる検討対象の薬剤、比較対照、対象とする
有効性・安全性検討事項及び対象期間の要素が含まれる。設定された課題に従っ
て、調査・試験デザイン、最終的に評価する指標値及び情報の取得方法等につい
て十分な検討を行う。
一般的に、製造販売承認(以下「承認」という。)に足る有効性に係る情報は、
承認時に評価された治験により収集されており、承認時に有効性に係る一定の
評価がなされている。したがって、承認審査の過程及び製造販売後に、評価すべ
き具体的な検討事項が生じていない場合は、製造販売後の有効性については、製
造販売後調査等によらない、文献の分析等による方法で評価することで差し支
えない。一方、承認審査の過程及び製造販売後に、有効性に関する具体的な検討
事項が生じた場合は、当該事項を科学的に確認することが可能となる製造販売
後調査等を実施する必要がある。
安全性検討事項は、「医薬品リスク管理計画指針について」(平成 24 年4月
11 日付け薬食安発 0411 第1号及び薬食審査発 0411 第2号、厚生労働省医薬食
品局安全対策課長及び審査管理課長連名通知)に基づき設定されるが、安全性監
視計画の具体化については、科学的な観点及び現行の承認審査の過程を考慮す
ると、1)各安全性検討事項における製造販売後に明らかにしたい懸念事項の明
確化、2)懸念事項ごとの科学的に適切な対処方法の決定、3)各対処方法の関
連法令下における位置づけの整理、4)詳細な調査計画(プロトコル)の策定、
の大きく4ステップ(図参照)に分けることができ、原則としてステップ3まで
は承認時までに独立行政法人医薬品医療機器総合機構(以下「PMDA」という。)
と申請者間で合意される必要がある。それぞれのステップにおける特徴と留意
点を以下に示す。また、これらの検討にあたっては、下記通知(以下「安全性監
視関連通知」という。)も参照すること。