よむ、つかう、まなぶ。
資料2-6 「医薬品の製造販売後調査等の実施計画の策定に関する検討の進め方について」の一部改正について[977KB] (14 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44308.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
また、「追加の安全性監視」として非臨床試験が実施される場合には、
GVP 省令に加えて、医薬品の安全性に関する非臨床試験の実施の基準に関す
る省令(平成9年厚生省令第 21 号)の適用を受ける。
なお、一つのリサーチ・クエスチョンに対しては、GPSP 省令に基づく追加
の安全性監視として、原則、複数の枠組みの調査(例:使用成績調査と製造
販売後データベース調査)が並行して実施されることはない。
また、一品目で複数のリサーチ・クエスチョンが存在する際には、それぞ
れの対処方法に応じた調査等が選択される。その時に、それらの調査等を併
せて実施する際の実現可能性を吟味し、必要に応じて複数のリサーチ・クエ
スチョンに対応して実施可能な調査等を検討することもある。
なお、再審査の対象とされた新医薬品について、法令上、一律に製造販売
後調査等を実施することが義務づけられているとは解されない。また、製造
販売後調査等を実施することが再審査期間の付与の前提となるものではな
い。
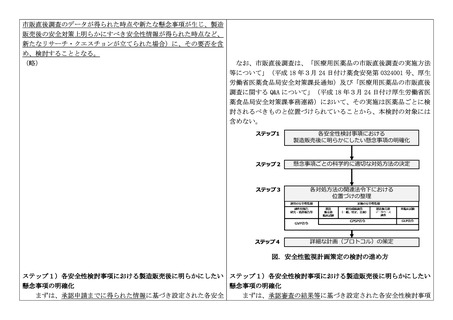
ステップ4) 詳細な計画(プロトコル)の策定
ステップ3で位置づけを明らかにした各対処方法に対して具体的な計画
(プロトコル)を策定する。プロトコルの作成にあたってはリサーチ・クエス
チョンに照らし合わせて、科学的な観点から、対象集団の適格基準、曝露(薬
剤服用)の定義、アウトカム定義、対象症例数及び解析方法等を含めて詳細な
検討を行う。プロトコルの詳細については、PMDA が実施している対面助言制
度「医薬品製造販売後臨床試験等計画相談」及び「医薬品疫学調査計画相談」
等を利用して検討することも可能である。
なお、製造販売後データベース調査の計画にあたっては、安全性監視関連通
知のほか、PMDA が作成しホームページに掲載している「医療情報のデータベ
ース等を用いた医薬品の安全性評価における薬剤疫学研究の実施に関するガ
イドライン」(平成 26 年3月 31 日付け公表)、「製造販売後データベース
調査実施計画書の記載要領」(平成 30 年1月 23 日付け公表)等を参照された
い。
GVP 省令に加えて、医薬品の安全性に関する非臨床試験の実施の基準に関す
る省令(平成9年厚生省令第 21 号)の適用を受ける。
なお、一つのリサーチ・クエスチョンに対しては、GPSP 省令に基づく追加
の安全性監視として、原則、複数の枠組みの調査(例:使用成績調査と製造
販売後データベース調査)が並行して実施されることはない。
また、一品目で複数のリサーチ・クエスチョンが存在する際には、それぞ
れの対処方法に応じた調査等が選択される。その時に、それらの調査等を併
せて実施する際の実現可能性を吟味し、必要に応じて複数のリサーチ・クエ
スチョンに対応して実施可能な調査等を検討することもある。
なお、再審査の対象とされた新医薬品について、法令上、一律に製造販売
後調査等を実施することが義務づけられているとは解されない。また、製造
販売後調査等を実施することが再審査期間の付与の前提となるものではな
い。
ステップ4) 詳細な計画(プロトコル)の策定
ステップ3で位置づけを明らかにした各対処方法に対して具体的な計画
(プロトコル)を策定する。プロトコルの作成にあたってはリサーチ・クエス
チョンに照らし合わせて、科学的な観点から、対象集団の適格基準、曝露(薬
剤服用)の定義、アウトカム定義、対象症例数及び解析方法等を含めて詳細な
検討を行う。プロトコルの詳細については、PMDA が実施している対面助言制
度「医薬品製造販売後臨床試験等計画相談」及び「医薬品疫学調査計画相談」
等を利用して検討することも可能である。
なお、製造販売後データベース調査の計画にあたっては、安全性監視関連通
知のほか、PMDA が作成しホームページに掲載している「医療情報のデータベ
ース等を用いた医薬品の安全性評価における薬剤疫学研究の実施に関するガ
イドライン」(平成 26 年3月 31 日付け公表)、「製造販売後データベース
調査実施計画書の記載要領」(平成 30 年1月 23 日付け公表)等を参照された
い。