よむ、つかう、まなぶ。
資料2-6 「医薬品の製造販売後調査等の実施計画の策定に関する検討の進め方について」の一部改正について[977KB] (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44308.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
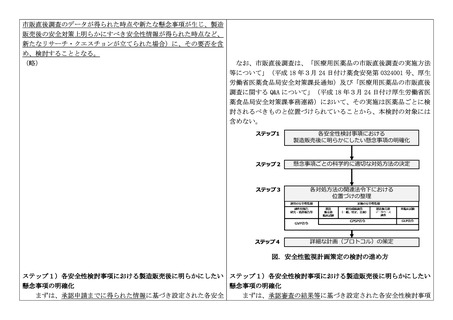
性検討事項について、製造販売後の具体的な懸念事項(それぞれ何
について、製造販売後の具体的な懸念事項(それぞれ何が明らかに
が明らかになればよいのか、懸念に対する対応策の要否及び内容を
判断する材料として十分な情報とは何か、いつその対応策を実施す
べきか)を明確化する。
安全性検討事項のうち「重要な特定されたリスク」については、
医薬品と有害事象との因果関係が特定されており、基本的にはリス
ク最小化活動に重きをおくべきであるが、その好発時期や最適な処
置、リスク因子の特定等についてより詳細な情報が必要と考えられ
なればよいのか、懸念に対する対応策の要否及び内容を判断する材
料として十分な情報とは何か)を明確化する。
安全性検討事項のうち「重要な特定されたリスク」については、
医薬品と有害事象との因果関係が特定されており、製造販売後に明
らかにすべき懸念事項の例としては、リスク因子の特定等が考えら
れる。
る場合等では目的を明確にしたうえで調査の実施を検討した方がよ
い場合も考えられる。
安全性検討事項のうち「重要な潜在的リスク」については、医薬
品と有害事象との因果関係が特定されておらず、基本的には、医薬
品と有害事象との因果関係が製造販売後に明らかにすべき懸念事項
となる。
安全性検討事項のうち「重要な不足情報」については、例えば、
安全性検討事項のうち「重要な潜在的リスク」については、医薬
品と有害事象との因果関係が特定されておらず、基本的には、医薬
品と有害事象との因果関係が製造販売後に明らかにすべき懸念事項
となる。
安全性検討事項のうち「重要な不足情報」については、例えば、
臨床試験の対象には含まれなかったものの、製造販売後に当該医薬
品の使用が想定される集団において、既知の副作用の発現状況が他
の集団とは異なる可能性等が、製造販売後に明らかにすべき懸念事
項となりうる。
臨床試験の対象には含まれなかったものの、製造販売後に当該医薬
品の使用が想定される集団において、既知の副作用の発現状況が他
の集団とは異なる可能性等が、製造販売後に明らかにすべき懸念事
項となりうる。
ステップ2)懸念事項ごとの科学的に適切な対処方法の決定
ステップ2)懸念事項ごとの科学的に適切な対処方法の決定
ステップ1で明確にされた懸念事項の特性に応じて、科学的に最
ステップ1で明確にされた懸念事項の特性に応じて、科学的に最
も適切と考えられる対処方法を決定する。具体的には、ICH E2E ガ
イドライン通知の別添等を参照し、懸念事項ごとに検討する。懸念
事項の特性によっては、副作用報告及び文献の分析等の受動的サー
ベイランスのみが選択される場合もあり、必ずしも全ての懸念事項
に対して調査又は試験を実施する必要はない。単に治験の症例数(全
体又は日本人集団)が少ないことや一部の患者集団における情報が
不足していることのみが懸念事項である場合には、それが「重要な
も適切と考えられる対処方法を決定する。具体的には、ICH E2E ガ
イドライン通知の別添等を参照し、懸念事項ごとに検討する。懸念
事項の特性によっては、副作用報告及び文献の分析等の受動的サー
ベイランスのみが選択される場合もあり、必ずしも全ての懸念事項
に対して調査又は試験を実施する必要はない。
について、製造販売後の具体的な懸念事項(それぞれ何が明らかに
が明らかになればよいのか、懸念に対する対応策の要否及び内容を
判断する材料として十分な情報とは何か、いつその対応策を実施す
べきか)を明確化する。
安全性検討事項のうち「重要な特定されたリスク」については、
医薬品と有害事象との因果関係が特定されており、基本的にはリス
ク最小化活動に重きをおくべきであるが、その好発時期や最適な処
置、リスク因子の特定等についてより詳細な情報が必要と考えられ
なればよいのか、懸念に対する対応策の要否及び内容を判断する材
料として十分な情報とは何か)を明確化する。
安全性検討事項のうち「重要な特定されたリスク」については、
医薬品と有害事象との因果関係が特定されており、製造販売後に明
らかにすべき懸念事項の例としては、リスク因子の特定等が考えら
れる。
る場合等では目的を明確にしたうえで調査の実施を検討した方がよ
い場合も考えられる。
安全性検討事項のうち「重要な潜在的リスク」については、医薬
品と有害事象との因果関係が特定されておらず、基本的には、医薬
品と有害事象との因果関係が製造販売後に明らかにすべき懸念事項
となる。
安全性検討事項のうち「重要な不足情報」については、例えば、
安全性検討事項のうち「重要な潜在的リスク」については、医薬
品と有害事象との因果関係が特定されておらず、基本的には、医薬
品と有害事象との因果関係が製造販売後に明らかにすべき懸念事項
となる。
安全性検討事項のうち「重要な不足情報」については、例えば、
臨床試験の対象には含まれなかったものの、製造販売後に当該医薬
品の使用が想定される集団において、既知の副作用の発現状況が他
の集団とは異なる可能性等が、製造販売後に明らかにすべき懸念事
項となりうる。
臨床試験の対象には含まれなかったものの、製造販売後に当該医薬
品の使用が想定される集団において、既知の副作用の発現状況が他
の集団とは異なる可能性等が、製造販売後に明らかにすべき懸念事
項となりうる。
ステップ2)懸念事項ごとの科学的に適切な対処方法の決定
ステップ2)懸念事項ごとの科学的に適切な対処方法の決定
ステップ1で明確にされた懸念事項の特性に応じて、科学的に最
ステップ1で明確にされた懸念事項の特性に応じて、科学的に最
も適切と考えられる対処方法を決定する。具体的には、ICH E2E ガ
イドライン通知の別添等を参照し、懸念事項ごとに検討する。懸念
事項の特性によっては、副作用報告及び文献の分析等の受動的サー
ベイランスのみが選択される場合もあり、必ずしも全ての懸念事項
に対して調査又は試験を実施する必要はない。単に治験の症例数(全
体又は日本人集団)が少ないことや一部の患者集団における情報が
不足していることのみが懸念事項である場合には、それが「重要な
も適切と考えられる対処方法を決定する。具体的には、ICH E2E ガ
イドライン通知の別添等を参照し、懸念事項ごとに検討する。懸念
事項の特性によっては、副作用報告及び文献の分析等の受動的サー
ベイランスのみが選択される場合もあり、必ずしも全ての懸念事項
に対して調査又は試験を実施する必要はない。