よむ、つかう、まなぶ。
資料1-2:日本CRO協会 提出資料 (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_46147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第38回 11/28)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
【論点1.国際競争力の強化】
日本CRO協会としての取組みとお願い
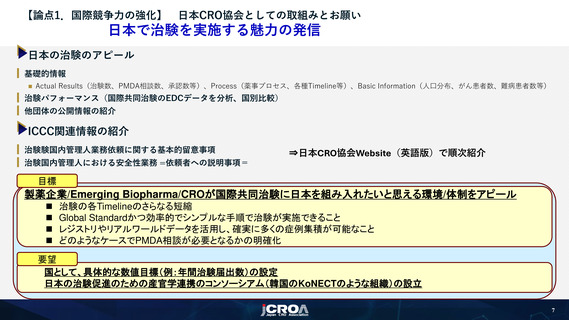
日本で治験を実施する魅力の発信
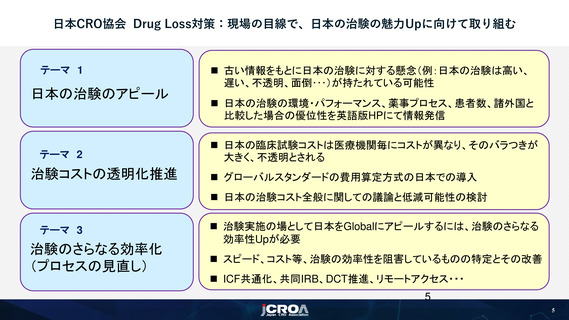
日本の治験のアピール
▍ 基礎的情報
◼ Actual Results(治験数、PMDA相談数、承認数等)、Process(薬事プロセス、各種Timeline等)、Basic Information(人口分布、がん患者数、難病患者数等)
▍ 治験パフォーマンス(国際共同治験のEDCデータを分析、国別比較)
▍ 他団体の公開情報の紹介
ICCC関連情報の紹介
▍ 治験験国内管理人業務依頼に関する基本的留意事項
▍ 治験国内管理人における安全性業務 =依頼者への説明事項=
⇒日本CRO協会Website(英語版)で順次紹介
目標
製薬企業/Emerging Biopharma/CROが国際共同治験に日本を組み入れたいと思える環境/体制をアピール
◼ 治験の各Timelineのさらなる短縮
◼ Global Standardかつ効率的でシンプルな手順で治験が実施できること
◼ レジストリやリアルワールドデータを活用し、確実に多くの症例集積が可能なこと
◼ どのようなケースでPMDA相談が必要となるかの明確化
要望
国として、具体的な数値目標(例:年間治験届出数)の設定
日本の治験促進のための産官学連携のコンソーシアム(韓国のKoNECTのような組織)の設立
7
日本CRO協会としての取組みとお願い
日本で治験を実施する魅力の発信
日本の治験のアピール
▍ 基礎的情報
◼ Actual Results(治験数、PMDA相談数、承認数等)、Process(薬事プロセス、各種Timeline等)、Basic Information(人口分布、がん患者数、難病患者数等)
▍ 治験パフォーマンス(国際共同治験のEDCデータを分析、国別比較)
▍ 他団体の公開情報の紹介
ICCC関連情報の紹介
▍ 治験験国内管理人業務依頼に関する基本的留意事項
▍ 治験国内管理人における安全性業務 =依頼者への説明事項=
⇒日本CRO協会Website(英語版)で順次紹介
目標
製薬企業/Emerging Biopharma/CROが国際共同治験に日本を組み入れたいと思える環境/体制をアピール
◼ 治験の各Timelineのさらなる短縮
◼ Global Standardかつ効率的でシンプルな手順で治験が実施できること
◼ レジストリやリアルワールドデータを活用し、確実に多くの症例集積が可能なこと
◼ どのようなケースでPMDA相談が必要となるかの明確化
要望
国として、具体的な数値目標(例:年間治験届出数)の設定
日本の治験促進のための産官学連携のコンソーシアム(韓国のKoNECTのような組織)の設立
7