よむ、つかう、まなぶ。
資料1-3:臨床研究中核病院連携協議会(千葉大学医学部附属病院) 花岡参考人 提出資料 (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_49984.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第39回 1/29)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
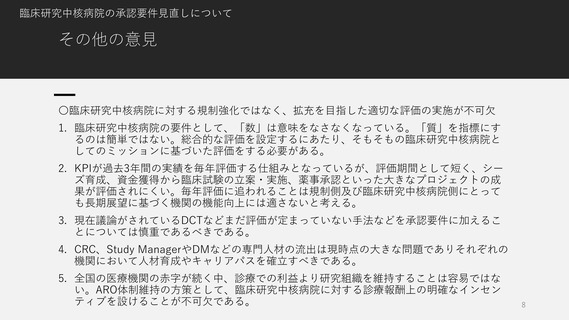
臨床研究中核病院の承認要件見直しについて
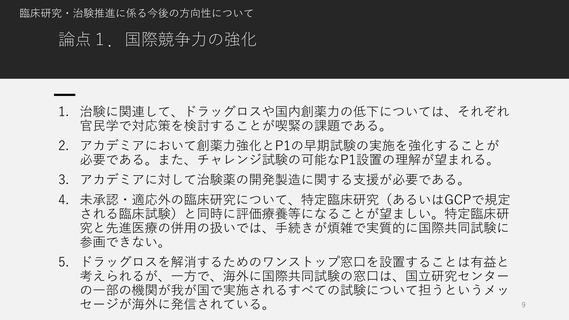
論点2.国際競争力が高く、優れた(疾患特異的な)臨床開発力
を有する臨床研究中核病院の役割・機能はどうあるべきか。
〇各機関一律に求めるのではなく、各機関の強みを伸ばす方向がよいのではないか。
〇何をもって国際競争力が高いと評価するのか。
1. 日本の臨床試験(或いは臨床研究)を推進し、国際競争力を高め、世界の中で日本のプレ
ゼンスを向上し、革新的な医療を患者さんへ提供することに貢献することは共通の認識と
考える。
2. 臨床研究中核病院が各自で強みを発揮できるような役割分担(疾患領域毎、モダリティ
毎)はあってもよいが、何をもって国際競争力が高いと評価するのか、臨床開発力が優れ
ているか等については、ステークホルダーの目線合わせが必要である。
3. グローバルに先駆けた本邦でのFIH試験実施体制の整備や実績や、臨床開発のゴールである
薬事承認取得への貢献度も加味した評価となると、極めて長い期間を要するので、適切な
評価指標の検討が必要である。
4. 具体化するための財政的基盤強化の議論も必要である。国として臨床研究の国際競争力を
高めるために定めた目指すべき方向に臨床研究中核病院の制度を活用するのであれば、こ
の領域の研究費の強化や、より積極的に安定的な(診療報酬を含む)財政的支援が必要で
ある。
6
論点2.国際競争力が高く、優れた(疾患特異的な)臨床開発力
を有する臨床研究中核病院の役割・機能はどうあるべきか。
〇各機関一律に求めるのではなく、各機関の強みを伸ばす方向がよいのではないか。
〇何をもって国際競争力が高いと評価するのか。
1. 日本の臨床試験(或いは臨床研究)を推進し、国際競争力を高め、世界の中で日本のプレ
ゼンスを向上し、革新的な医療を患者さんへ提供することに貢献することは共通の認識と
考える。
2. 臨床研究中核病院が各自で強みを発揮できるような役割分担(疾患領域毎、モダリティ
毎)はあってもよいが、何をもって国際競争力が高いと評価するのか、臨床開発力が優れ
ているか等については、ステークホルダーの目線合わせが必要である。
3. グローバルに先駆けた本邦でのFIH試験実施体制の整備や実績や、臨床開発のゴールである
薬事承認取得への貢献度も加味した評価となると、極めて長い期間を要するので、適切な
評価指標の検討が必要である。
4. 具体化するための財政的基盤強化の議論も必要である。国として臨床研究の国際競争力を
高めるために定めた目指すべき方向に臨床研究中核病院の制度を活用するのであれば、こ
の領域の研究費の強化や、より積極的に安定的な(診療報酬を含む)財政的支援が必要で
ある。
6