よむ、つかう、まなぶ。
資料1-3:臨床研究中核病院連携協議会(千葉大学医学部附属病院) 花岡参考人 提出資料 (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_49984.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第39回 1/29)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
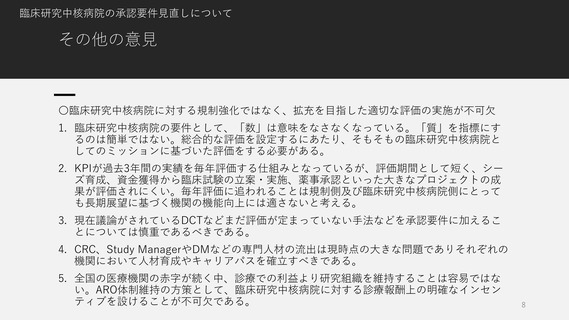
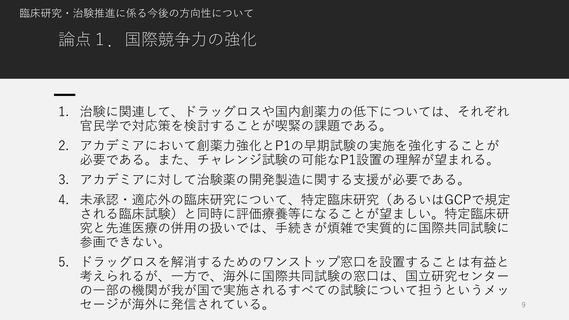
臨床研究・治験推進に係る今後の方向性について
論点1.国際競争力の強化
1. 治験に関連して、ドラッグロスや国内創薬力の低下については、それぞれ
官民学で対応策を検討することが喫緊の課題である。
2. アカデミアにおいて創薬力強化とP1の早期試験の実施を強化することが
必要である。また、チャレンジ試験の可能なP1設置の理解が望まれる。
3. アカデミアに対して治験薬の開発製造に関する支援が必要である。
4. 未承認・適応外の臨床研究について、特定臨床研究(あるいはGCPで規定
される臨床試験)と同時に評価療養等になることが望ましい。特定臨床研
究と先進医療の併用の扱いでは、手続きが煩雑で実質的に国際共同試験に
参画できない。
5. ドラッグロスを解消するためのワンストップ窓口を設置することは有益と
考えられるが、一方で、海外に国際共同試験の窓口は、国立研究センター
の一部の機関が我が国で実施されるすべての試験について担うというメッ
セージが海外に発信されている。
9
論点1.国際競争力の強化
1. 治験に関連して、ドラッグロスや国内創薬力の低下については、それぞれ
官民学で対応策を検討することが喫緊の課題である。
2. アカデミアにおいて創薬力強化とP1の早期試験の実施を強化することが
必要である。また、チャレンジ試験の可能なP1設置の理解が望まれる。
3. アカデミアに対して治験薬の開発製造に関する支援が必要である。
4. 未承認・適応外の臨床研究について、特定臨床研究(あるいはGCPで規定
される臨床試験)と同時に評価療養等になることが望ましい。特定臨床研
究と先進医療の併用の扱いでは、手続きが煩雑で実質的に国際共同試験に
参画できない。
5. ドラッグロスを解消するためのワンストップ窓口を設置することは有益と
考えられるが、一方で、海外に国際共同試験の窓口は、国立研究センター
の一部の機関が我が国で実施されるすべての試験について担うというメッ
セージが海外に発信されている。
9