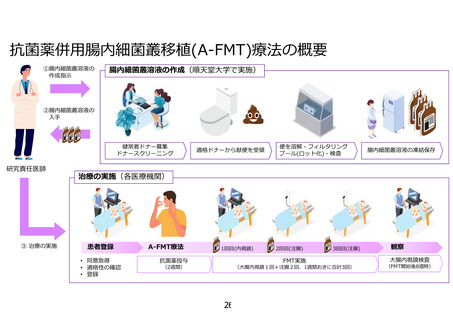
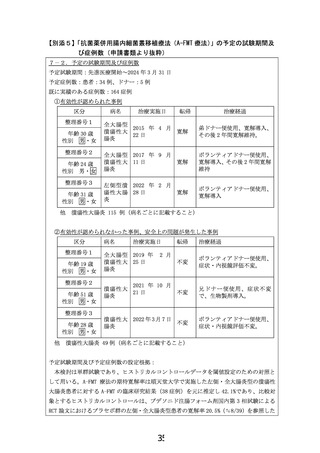
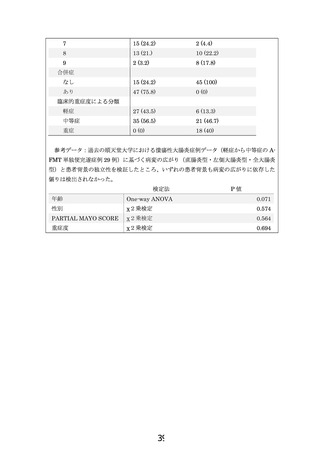
よむ、つかう、まなぶ。
別紙1○【先進医療合同会議】先進医療Bに係る新規技術の科学的評価等について (31 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00053.html |
| 出典情報 | 先進医療会議(第117回先進医療会議、第142回先進医療技術審査部会 12/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
・整腸剤:適格性確認日前 1 週間
3)下記の薬物療法について、下記に示す期間内に用法・用量を変更した患者(投与経路が同
じであれば、剤型のみの変更は不問とする)
・5-ASA 製剤(経口剤)
:適格性確認日前 4 週間
4)大腸切除歴を有する患者又は研究期間中に消化管に対する外科的治療が予定されている患
者
5)臨床的に感染性腸炎の合併が疑われる患者
6)結核性疾患の患者
7)門脈圧亢進症の兆候を有する肝硬変(末期の原発性胆汁性肝硬変など)の患者
8)有効な抗菌薬の存在しない感染症、深在性真菌症の患者
9)重篤な心疾患を有する患者
10)腎障害(血清クレアチニンが 2.0mg/dL 以上、あるいは BUN が 25mg/dL 以上を示す)を有
する患者
11)肝障害(総ビリルビンが 3.0mg/dL 以上又は AST(GOT)もしくは ALT(GPT)※が 100IU/L
以上を示す)を有する患者
12)悪性腫瘍を有する又は治療後 5 年経過していない患者
13)明らかな精神症状を有する患者(治療の有無にかかわらず「医薬品の副作用の重篤度分
類基準について」(平成 4 年 6 月 29 日、薬案第 80 号)グレード 2 以上に相当する状態)
14)薬物依存、アルコール依存の既往又は合併症を有する患者
15)妊婦、授乳婦、妊娠している可能性のある女性、同意取得時から治療期間中に妊娠を希
望する女性及び適切な方法での避妊(子宮内避妊用具、ペッサリー又はパートナーのコンド
ーム使用遵守:ただし、経口避妊薬は使用禁止)に合意できない女性
16)同意取得時に追跡調査を含む他の臨床研究や治験に参加している患者
17)本研究実施計画書に定められた検査・観察等の実施前 12 週間以内に他の治験薬を投与し
ていた患者
18)その他、研究責任(分担)医師が研究対象者として不適当と判断した患者
患者選定方法
1)研究責任(分担)医師は、選択基準及び除外基準に基づいた適合条件に合致している者か
ら、研究対象者の自由意思に基づく文書同意を得る。患者が未成年の場合、本人に加え代諾
者の同意も得る。代諾者は親権者(父母)を基本とし、困難であれば患者の意思および利益
を代弁できると考えられる祖父母・同居の親族も可とする。
2)研究責任(分担)医師は、研究対象者に問診、診察を実施し、選択基準を満たし、かつ除
外基準を満たさないことを確認する。
3)適格性確認票の記入をもって登録完了とする。研究責任(分担)医師は、適格性確認票に
研究対象者の生年月日、性別等の背景情報及び研究対象者識別コードを記入し、選択基準・
除外基準に問題がないことを記入し保管する。
<ドナー適格性基準>
下記の選択基準を全て満たし、かつ除外基準のいずれにも該当しない研究対象者を対象とす
31
3)下記の薬物療法について、下記に示す期間内に用法・用量を変更した患者(投与経路が同
じであれば、剤型のみの変更は不問とする)
・5-ASA 製剤(経口剤)
:適格性確認日前 4 週間
4)大腸切除歴を有する患者又は研究期間中に消化管に対する外科的治療が予定されている患
者
5)臨床的に感染性腸炎の合併が疑われる患者
6)結核性疾患の患者
7)門脈圧亢進症の兆候を有する肝硬変(末期の原発性胆汁性肝硬変など)の患者
8)有効な抗菌薬の存在しない感染症、深在性真菌症の患者
9)重篤な心疾患を有する患者
10)腎障害(血清クレアチニンが 2.0mg/dL 以上、あるいは BUN が 25mg/dL 以上を示す)を有
する患者
11)肝障害(総ビリルビンが 3.0mg/dL 以上又は AST(GOT)もしくは ALT(GPT)※が 100IU/L
以上を示す)を有する患者
12)悪性腫瘍を有する又は治療後 5 年経過していない患者
13)明らかな精神症状を有する患者(治療の有無にかかわらず「医薬品の副作用の重篤度分
類基準について」(平成 4 年 6 月 29 日、薬案第 80 号)グレード 2 以上に相当する状態)
14)薬物依存、アルコール依存の既往又は合併症を有する患者
15)妊婦、授乳婦、妊娠している可能性のある女性、同意取得時から治療期間中に妊娠を希
望する女性及び適切な方法での避妊(子宮内避妊用具、ペッサリー又はパートナーのコンド
ーム使用遵守:ただし、経口避妊薬は使用禁止)に合意できない女性
16)同意取得時に追跡調査を含む他の臨床研究や治験に参加している患者
17)本研究実施計画書に定められた検査・観察等の実施前 12 週間以内に他の治験薬を投与し
ていた患者
18)その他、研究責任(分担)医師が研究対象者として不適当と判断した患者
患者選定方法
1)研究責任(分担)医師は、選択基準及び除外基準に基づいた適合条件に合致している者か
ら、研究対象者の自由意思に基づく文書同意を得る。患者が未成年の場合、本人に加え代諾
者の同意も得る。代諾者は親権者(父母)を基本とし、困難であれば患者の意思および利益
を代弁できると考えられる祖父母・同居の親族も可とする。
2)研究責任(分担)医師は、研究対象者に問診、診察を実施し、選択基準を満たし、かつ除
外基準を満たさないことを確認する。
3)適格性確認票の記入をもって登録完了とする。研究責任(分担)医師は、適格性確認票に
研究対象者の生年月日、性別等の背景情報及び研究対象者識別コードを記入し、選択基準・
除外基準に問題がないことを記入し保管する。
<ドナー適格性基準>
下記の選択基準を全て満たし、かつ除外基準のいずれにも該当しない研究対象者を対象とす
31