よむ、つかう、まなぶ。
別紙1○【先進医療合同会議】先進医療Bに係る新規技術の科学的評価等について (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00053.html |
| 出典情報 | 先進医療会議(第117回先進医療会議、第142回先進医療技術審査部会 12/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
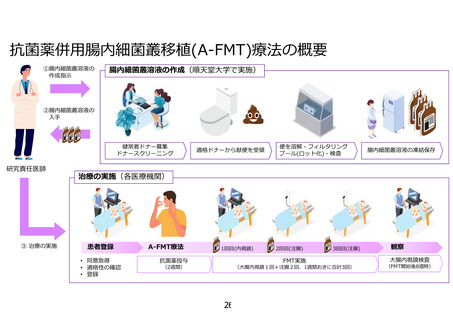
(臨床研究の説明文書・同意書(ドナーの方)について)
12.そもそもどのようにして便提供者を集めるのですか?これまでの経験上、どういう人がドナーにな
ることが多いですか。
【回答】
研究計画書「6.1. 登録方法」のドナー候補者の募集方法に係る記載を同意説明文書「1-2 臨床研究の
方法」の「(1)対象となるドナーの方」の項目に追記します。なお、これまでは患者様のご家族や順天堂大
学の関係者にドナーとして多くご協力いただきました。
13.2-1 の「当院での実施体制」にある情報は、次の 2-2 記載の情報と完全に重複しています。「当
院での実施体制」というタイトルで書くべき内容は、研究責任医師以下の研究体制、メンバー等では
ないでしょうか。患者さんの立場に立っても、誰がこの治療法を実際に担当するか、担当する可能性
があるかは知っておきたいのではないでしょうか。
【回答】
「臨床研究の説明文書・同意書(患者さん)について」の照会事項 1 と同様のご指摘と理解しました。当
該照会事項の回答と同様に、研究責任医師以下の研究体制情報を追記するとともに、2-1 及び 2-2 の
記載を整備します。
14.2-3 に共同研究機関として、メタジェンセラピューティクス社についての情報を加筆してください。
【回答】
「臨床研究の説明文書・同意書(患者さん)について」の照会事項 2 と同様のご指摘と理解しました。当
該照会事項の回答と同様に、2-3 は共同実施医療機関に係る記載になりますので、「2-4 共同研究機
関」の項目を新たに設定してメタジェンセラピューティクス社の情報を追記します。
15.10-3 の第 1 パラグラフと第 3 パラグラフの内容は矛盾しているのではないでしょうか。本研究の
残余検体等の二次利用について、第 1 パラグラフではオプトアウト対応をすると書いてある一方で、
第 3 パラグラフではこの説明に基づく同意だけで二次利用も自由に行えるように書かれている点に
は矛盾があると考えます。
また、本研究で取得した試料を別の研究に二次利用する場合には、別の研究が準拠する規制に従う
ことになりますが、研究倫理指針や臨床研究法では、試料の利用に関して、利用範囲を特定しない
包括的な同意は認められていないはずです(バイオバンクで収集・分譲する場合を除いて)。
【回答】
4
8
12.そもそもどのようにして便提供者を集めるのですか?これまでの経験上、どういう人がドナーにな
ることが多いですか。
【回答】
研究計画書「6.1. 登録方法」のドナー候補者の募集方法に係る記載を同意説明文書「1-2 臨床研究の
方法」の「(1)対象となるドナーの方」の項目に追記します。なお、これまでは患者様のご家族や順天堂大
学の関係者にドナーとして多くご協力いただきました。
13.2-1 の「当院での実施体制」にある情報は、次の 2-2 記載の情報と完全に重複しています。「当
院での実施体制」というタイトルで書くべき内容は、研究責任医師以下の研究体制、メンバー等では
ないでしょうか。患者さんの立場に立っても、誰がこの治療法を実際に担当するか、担当する可能性
があるかは知っておきたいのではないでしょうか。
【回答】
「臨床研究の説明文書・同意書(患者さん)について」の照会事項 1 と同様のご指摘と理解しました。当
該照会事項の回答と同様に、研究責任医師以下の研究体制情報を追記するとともに、2-1 及び 2-2 の
記載を整備します。
14.2-3 に共同研究機関として、メタジェンセラピューティクス社についての情報を加筆してください。
【回答】
「臨床研究の説明文書・同意書(患者さん)について」の照会事項 2 と同様のご指摘と理解しました。当
該照会事項の回答と同様に、2-3 は共同実施医療機関に係る記載になりますので、「2-4 共同研究機
関」の項目を新たに設定してメタジェンセラピューティクス社の情報を追記します。
15.10-3 の第 1 パラグラフと第 3 パラグラフの内容は矛盾しているのではないでしょうか。本研究の
残余検体等の二次利用について、第 1 パラグラフではオプトアウト対応をすると書いてある一方で、
第 3 パラグラフではこの説明に基づく同意だけで二次利用も自由に行えるように書かれている点に
は矛盾があると考えます。
また、本研究で取得した試料を別の研究に二次利用する場合には、別の研究が準拠する規制に従う
ことになりますが、研究倫理指針や臨床研究法では、試料の利用に関して、利用範囲を特定しない
包括的な同意は認められていないはずです(バイオバンクで収集・分譲する場合を除いて)。
【回答】
4
8