よむ、つかう、まなぶ。
参考資料11 ワクチンの副反応に対する考え方及び評価について(令和3年2月15日合同部会資料3) (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00056.html |
| 出典情報 | 第89回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第21回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(12/16)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
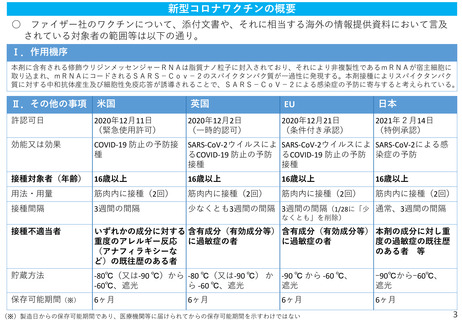
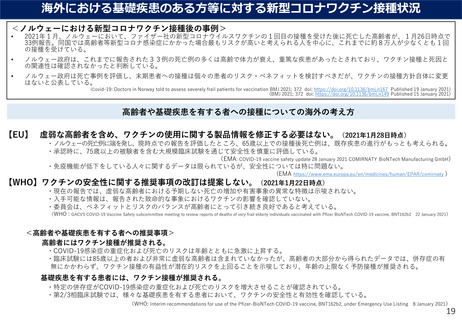
新型コロナウイルス感染症に係るワクチンの安全性について
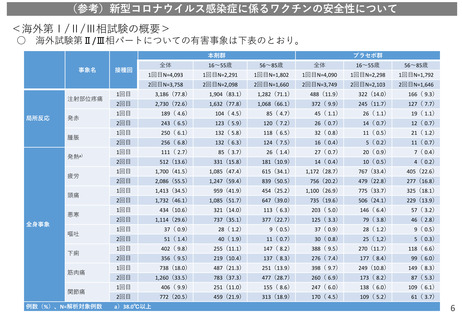
<海外第Ⅰ/Ⅱ/Ⅲ相試験と国内第Ⅰ/Ⅱ相試験での概要>
○ 現時点の情報において、被験者の多くに反応原性事象として収集された局所反応及び全身事象が
認められていたものの、ほとんどが軽度又は中等度であり、回復性が認められる。
頻度の高いAE(※)について
16歳以上の被接種者に生じた頻度の高いAEは以下の通りであった(詳細は参考資料に掲載)。
通常は軽度又中度で、接種後数日で消失した。なお、国内治験でも同様の傾向が見られた。
接種部位の痛み(>80%)、疲労(>60%)、頭痛(>50%)、筋肉痛(>30%)、悪寒(>30%)、
関節痛(>20%)、下痢、発熱、接種部位の腫脹(>10%)
*発熱については、海外試験では38.0℃以上、国内治験では37.5℃以上で報告され、それぞれ13.6%、32.8%であった。
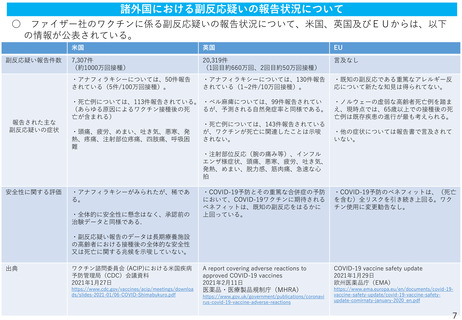
SAE(※)について
本剤群126/21,621例(0.6%)、プラセボ群111/21,631例(0.5%)に認められた。治療薬との関
連が否定されなかった事象(4例)の転帰は、リンパ節症は未回復、心室性不整脈は回復、その
他の事象は軽快であった。
死亡例は、本剤群2例(動脈硬化症及び心停止各1例)、プラセボ群4例(原因不明2例、出血性
卒中及び心筋梗塞各1例)に認められ、いずれも治験薬との因果関係は否定された。
なお、国内治験では死亡及び重篤な有害事象は認められなかった。
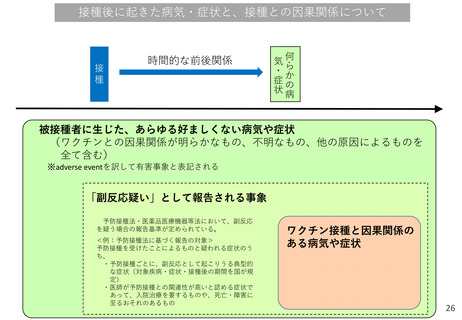
※ 「AE(Adverse Event)」とは、医薬品の使用と時間的に関連のある、あらゆる好ましくない、意図しない徴候、症状又は疾
病のことであり、当該医薬品との因果関係の有無は問わない。例えば、ワクチン接種後に地震が発生して負傷した場合も、ワ
クチン接種との因果関係にかかわらず、時間的な関連があるためAEとして扱われる。「SAE (Serious Adverse Event) 」は
重篤なAEをいう。
5
<海外第Ⅰ/Ⅱ/Ⅲ相試験と国内第Ⅰ/Ⅱ相試験での概要>
○ 現時点の情報において、被験者の多くに反応原性事象として収集された局所反応及び全身事象が
認められていたものの、ほとんどが軽度又は中等度であり、回復性が認められる。
頻度の高いAE(※)について
16歳以上の被接種者に生じた頻度の高いAEは以下の通りであった(詳細は参考資料に掲載)。
通常は軽度又中度で、接種後数日で消失した。なお、国内治験でも同様の傾向が見られた。
接種部位の痛み(>80%)、疲労(>60%)、頭痛(>50%)、筋肉痛(>30%)、悪寒(>30%)、
関節痛(>20%)、下痢、発熱、接種部位の腫脹(>10%)
*発熱については、海外試験では38.0℃以上、国内治験では37.5℃以上で報告され、それぞれ13.6%、32.8%であった。
SAE(※)について
本剤群126/21,621例(0.6%)、プラセボ群111/21,631例(0.5%)に認められた。治療薬との関
連が否定されなかった事象(4例)の転帰は、リンパ節症は未回復、心室性不整脈は回復、その
他の事象は軽快であった。
死亡例は、本剤群2例(動脈硬化症及び心停止各1例)、プラセボ群4例(原因不明2例、出血性
卒中及び心筋梗塞各1例)に認められ、いずれも治験薬との因果関係は否定された。
なお、国内治験では死亡及び重篤な有害事象は認められなかった。
※ 「AE(Adverse Event)」とは、医薬品の使用と時間的に関連のある、あらゆる好ましくない、意図しない徴候、症状又は疾
病のことであり、当該医薬品との因果関係の有無は問わない。例えば、ワクチン接種後に地震が発生して負傷した場合も、ワ
クチン接種との因果関係にかかわらず、時間的な関連があるためAEとして扱われる。「SAE (Serious Adverse Event) 」は
重篤なAEをいう。
5