よむ、つかう、まなぶ。
資料2 生物学的製剤基準の一部改正について (16 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29912.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第6回 12/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
インフルエンザ HA ワクチンの異常毒性否定試験の生物学的製剤基準からの削除について
国立感染症研究所
異常毒性否定試験は、ワクチン・血液製剤等のロットの均一性を確認する品質管理試験として
長年に渡って用いられて来た試験であるが、近年、WHO ECBS において過去の実績や 3R の観点か
ら異常毒性否定試験の必要性が議論され、2018 年に生物学的製剤の安全性や品質を保証するに
は、異常毒性否定試験を実施するよりも、GMP や包括的に品質管理が確認される現在の製造管理
がより適切であると考えられることから、生物学的製剤に異常毒性否定試験を実施しない方針と
なった。以降この方針について世界的に協力が求められている。FDA および EMA ではそれぞれ
2015 年、2019 年に異常毒性否定試験が削除された。日本においては、SLP 審査導入を機に異常
毒性否定試験を継続して実施する必要のない製剤については生物学的製剤基準(以下、生物基)
に試験省略を可能とする規定を導入して来た。インフルエンザ HA ワクチンは、2010 年~2015 年
の過去 6 年間の試験結果について問題がないことが確認され、2020 年の生物基改正にて試験省
略が可能となった。
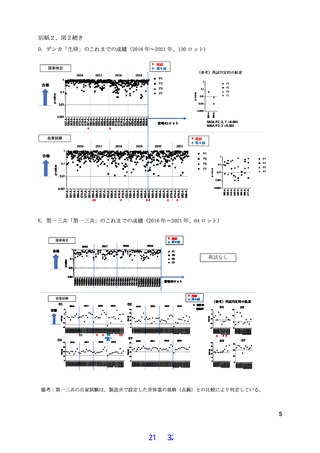
今回、標記の製剤について、試験省略のための評価後の 2016 年から 2021 年までの期間(6 年
間)を対象期間とし、対象期間における異常毒性否定試験の検定・自家試験の実施状況および結
果を評価し、生物基から試験の削除の可能性について検討した。
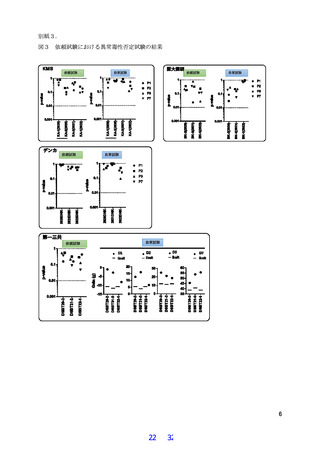
その結果、対象期間において異常毒性否定試験は全社の全ロットで合格し、ロットの均一性が
確認された。また製造株の変更も試験の結果に影響しないことを確認した。これらのことから
GMP や現在の製造工程の品質管理が十分に機能して品質が安定して維持されていることが確認で
きたため、WHO の方針に従って生物基から異常毒性否定試験を削除しても、今後もこれまでと同
等の品質管理が可能であると考えられた。
本結論について所内検定検査業務委員会(2022.7.22)及び検定検査協議会(2022.8.4)にて
議論の上、承認を得たため国立感染症研究所の意見として厚生労働省に報告する。
16 / 32
国立感染症研究所
異常毒性否定試験は、ワクチン・血液製剤等のロットの均一性を確認する品質管理試験として
長年に渡って用いられて来た試験であるが、近年、WHO ECBS において過去の実績や 3R の観点か
ら異常毒性否定試験の必要性が議論され、2018 年に生物学的製剤の安全性や品質を保証するに
は、異常毒性否定試験を実施するよりも、GMP や包括的に品質管理が確認される現在の製造管理
がより適切であると考えられることから、生物学的製剤に異常毒性否定試験を実施しない方針と
なった。以降この方針について世界的に協力が求められている。FDA および EMA ではそれぞれ
2015 年、2019 年に異常毒性否定試験が削除された。日本においては、SLP 審査導入を機に異常
毒性否定試験を継続して実施する必要のない製剤については生物学的製剤基準(以下、生物基)
に試験省略を可能とする規定を導入して来た。インフルエンザ HA ワクチンは、2010 年~2015 年
の過去 6 年間の試験結果について問題がないことが確認され、2020 年の生物基改正にて試験省
略が可能となった。
今回、標記の製剤について、試験省略のための評価後の 2016 年から 2021 年までの期間(6 年
間)を対象期間とし、対象期間における異常毒性否定試験の検定・自家試験の実施状況および結
果を評価し、生物基から試験の削除の可能性について検討した。
その結果、対象期間において異常毒性否定試験は全社の全ロットで合格し、ロットの均一性が
確認された。また製造株の変更も試験の結果に影響しないことを確認した。これらのことから
GMP や現在の製造工程の品質管理が十分に機能して品質が安定して維持されていることが確認で
きたため、WHO の方針に従って生物基から異常毒性否定試験を削除しても、今後もこれまでと同
等の品質管理が可能であると考えられた。
本結論について所内検定検査業務委員会(2022.7.22)及び検定検査協議会(2022.8.4)にて
議論の上、承認を得たため国立感染症研究所の意見として厚生労働省に報告する。
16 / 32