よむ、つかう、まなぶ。
資料2 生物学的製剤基準の一部改正について (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29912.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第6回 12/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
1. 対象製剤について
・ 製剤担当室:ウイルス第三部第四室
表 1. 対象製剤リスト (4 社、5 製剤)
製造所
販売名
一般財団法人阪大微生物病研究会
「ビケンHA」
フルービックHA
*2
フルービックHAシリンジ
*2
内容量*1
販売年
1mL
1972
0.5mL
0.5mL
2005
2008
KM バイオロジクス株式会社
「KMB」
1mL
1972
デンカ株式会社
「生研」
1mL
1986
第一三共株式会社
「第一三共」1mL
1mL
1986
*1 : 2015 年度までは、各社 0.25mL または 0.5mL 製剤が販売されたが、2016 年度以降出検されていない。これ
らのワクチンの組成は各社の 1mL 製剤と同じである。
*2 : チメロサールフリー製剤。
・製剤の特徴
本剤は、下表*3 のインフルエンザウイルスの A 型及び B 型株をそれぞれ個別に発育鶏卵で培養
し、増殖したウイルスを含む尿膜腔液をゾーナル遠心機による蔗糖密度勾配遠心法により濃縮精
製後、ウイルス粒子をエーテル等により処理して分解・不活化したヘムアグルチニン(HA)画分
に、リン酸塩緩衝塩化ナトリウム液を用いて規定濃度に混合調製した液剤である。(ビケン HA
添付文書より、他社の記載も同様である。)。
*3: 2021/2022 シーズンの下表を参考に示す。
2. インフルエンザ HA ワクチンの異常毒性否定試験の記載について (生物学的製剤基準)
3.2.7 異常毒性否定試験
一般試験法の異常毒性否定試験法を準用して試験するとき,適合しなければならない.ただ
し、本剤の連続した 50 回の製品の試験において異常が認められないことが確認された場合に
は,以後の製品については,本試験を省くことができる.また,製造用株の変更により異常が認
められる場合には,この限りではない.
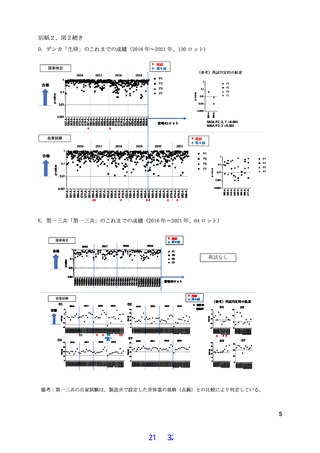
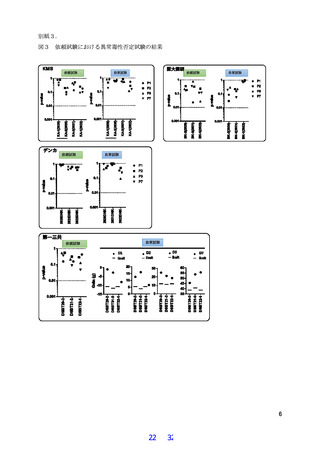
3.これまでの異常毒性否定試験の成績について
別紙 2 図 2、下表 2 に示す通り、対象期間の 6 年間において、4 社の全ロットについて、検定
および自家試験にて異常毒性否定試験(異毒)で合格しており、均一性が確認された。
1
17 / 32
・ 製剤担当室:ウイルス第三部第四室
表 1. 対象製剤リスト (4 社、5 製剤)
製造所
販売名
一般財団法人阪大微生物病研究会
「ビケンHA」
フルービックHA
*2
フルービックHAシリンジ
*2
内容量*1
販売年
1mL
1972
0.5mL
0.5mL
2005
2008
KM バイオロジクス株式会社
「KMB」
1mL
1972
デンカ株式会社
「生研」
1mL
1986
第一三共株式会社
「第一三共」1mL
1mL
1986
*1 : 2015 年度までは、各社 0.25mL または 0.5mL 製剤が販売されたが、2016 年度以降出検されていない。これ
らのワクチンの組成は各社の 1mL 製剤と同じである。
*2 : チメロサールフリー製剤。
・製剤の特徴
本剤は、下表*3 のインフルエンザウイルスの A 型及び B 型株をそれぞれ個別に発育鶏卵で培養
し、増殖したウイルスを含む尿膜腔液をゾーナル遠心機による蔗糖密度勾配遠心法により濃縮精
製後、ウイルス粒子をエーテル等により処理して分解・不活化したヘムアグルチニン(HA)画分
に、リン酸塩緩衝塩化ナトリウム液を用いて規定濃度に混合調製した液剤である。(ビケン HA
添付文書より、他社の記載も同様である。)。
*3: 2021/2022 シーズンの下表を参考に示す。
2. インフルエンザ HA ワクチンの異常毒性否定試験の記載について (生物学的製剤基準)
3.2.7 異常毒性否定試験
一般試験法の異常毒性否定試験法を準用して試験するとき,適合しなければならない.ただ
し、本剤の連続した 50 回の製品の試験において異常が認められないことが確認された場合に
は,以後の製品については,本試験を省くことができる.また,製造用株の変更により異常が認
められる場合には,この限りではない.
3.これまでの異常毒性否定試験の成績について
別紙 2 図 2、下表 2 に示す通り、対象期間の 6 年間において、4 社の全ロットについて、検定
および自家試験にて異常毒性否定試験(異毒)で合格しており、均一性が確認された。
1
17 / 32