よむ、つかう、まなぶ。
参考資料2 調査結果報告書 (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_31125.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第25回 2/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
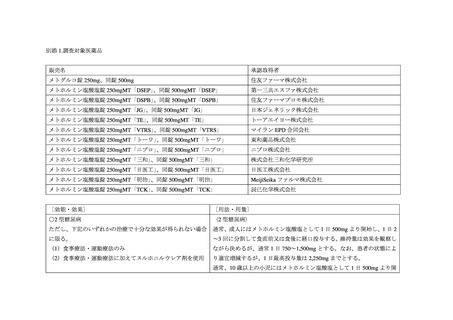
因子(腎機能障害、脱水、シックデイ、過度のアルコール摂取等)、患者への指導内容等に
関して注意喚起がなされている。
また、国内の標準的な教科書である内科学第 11 版(朝倉書店、2019)において、乳酸ア
シドーシスについてはビグアナイド系糖尿病用薬の副作用として知られている旨、メトホ
ルミン製剤に関連した乳酸アシドーシスの大半が投与禁忌や慎重投与症例に対して投与さ
れた場合である旨が記載されている。
一方、糖尿病に対する薬物治療に関して、糖尿病診療ガイドライン 2019(日本糖尿病学
会
編)において、本邦では第一選択薬を特に指定せず、病態に応じた薬剤選択が推奨され
ているが、糖尿病治療ガイド 2022-2023(日本糖尿病学会 編・著)においては、ビグアナ
イド系糖尿病用薬は血糖コントロール改善に際して体重が増加しにくいため、過体重又は
肥満を合併する 2 型糖尿病患者では第一選択となり、非肥満例にも有効である旨が記載さ
れている。また、糖尿病標準診療マニュアル第 8 版(2013 年、日本糖尿病・生活習慣病ヒ
ューマンデータ学会作成)では、糖尿病の薬物療法の第一選択としてビグアナイド系糖尿病
用薬又はグリクラジド・グリメピリドが推奨されていたが、同マニュアルの 2022 年版にお
いては、第一選択としてビグアナイド系糖尿病用薬が推奨されている。
V. 調査の結果を踏まえた機構の判断
IV 項の調査により、機構は、以下の点を踏まえ、再審査がすでに終了した本剤に、今後
も RMP の運用を要求する必要性は低く、承認条件としての RMP の策定解除 14に準じ、RMP
を終了したいとする承認取得者の見解は受け入れ可能であると考える。したがって、本剤及
び本剤の後発医薬品の RMP に基づく追加のリスク最小化活動を不要として差し支えないと
考える。
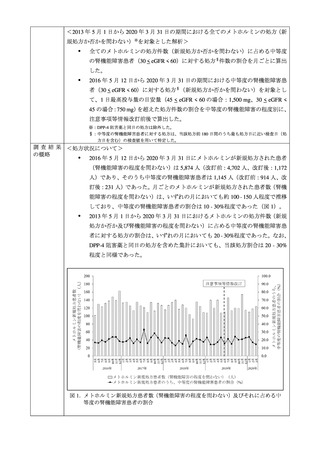
再審査期間中に認められた懸念である「禁忌患者への投与による乳酸アシドーシスの
報告」は現在も散見されるものの、再審査期間終了以降に、乳酸アシドーシスの報告数
が増加している傾向や、禁忌患者への投与時の乳酸アシドーシスの報告数が大幅に増
加している傾向は認められず、新たな安全性の懸念を認める状況とは言えないこと(図
1 及び図 2、並びに表 5 及び表 6 参照)。
MID-NET®調査において、禁忌に係る添付文書改訂後、メトホルミン製剤が新規処方さ
れた中等度の腎機能障害患者への初回投与量の遵守傾向が認められ、また、中等度の腎
機能患者において乳酸アシドーシスの発現は認められなかったことから、現在ではメ
トホルミン製剤が適切に投与されていることが示唆されること。
メトホルミン製剤による乳酸アシドーシスは、本邦の標準的な教科書にも記載されて
おり、医学薬学上公知の情報と考えられること。また、日本糖尿病学会が監修する「ビ
14
本邦において、一般的に承認条件として RMP の策定が付与されている医薬品については、RMP 上のリスクやリスク
最小化の資材の情報が医療現場に十分浸透しているか、新たな安全性の懸念がないか、既存のリスクの発現状況に大
幅な変化がないか等を評価したうえで、問題がないことが確認された場合、RMP の策定が解除される
https://www.pmda.go.jp/safety/info-services/drugs/items-information/rmp/0003.html(最終確認日:2023 年 1 月 25 日)
9
関して注意喚起がなされている。
また、国内の標準的な教科書である内科学第 11 版(朝倉書店、2019)において、乳酸ア
シドーシスについてはビグアナイド系糖尿病用薬の副作用として知られている旨、メトホ
ルミン製剤に関連した乳酸アシドーシスの大半が投与禁忌や慎重投与症例に対して投与さ
れた場合である旨が記載されている。
一方、糖尿病に対する薬物治療に関して、糖尿病診療ガイドライン 2019(日本糖尿病学
会
編)において、本邦では第一選択薬を特に指定せず、病態に応じた薬剤選択が推奨され
ているが、糖尿病治療ガイド 2022-2023(日本糖尿病学会 編・著)においては、ビグアナ
イド系糖尿病用薬は血糖コントロール改善に際して体重が増加しにくいため、過体重又は
肥満を合併する 2 型糖尿病患者では第一選択となり、非肥満例にも有効である旨が記載さ
れている。また、糖尿病標準診療マニュアル第 8 版(2013 年、日本糖尿病・生活習慣病ヒ
ューマンデータ学会作成)では、糖尿病の薬物療法の第一選択としてビグアナイド系糖尿病
用薬又はグリクラジド・グリメピリドが推奨されていたが、同マニュアルの 2022 年版にお
いては、第一選択としてビグアナイド系糖尿病用薬が推奨されている。
V. 調査の結果を踏まえた機構の判断
IV 項の調査により、機構は、以下の点を踏まえ、再審査がすでに終了した本剤に、今後
も RMP の運用を要求する必要性は低く、承認条件としての RMP の策定解除 14に準じ、RMP
を終了したいとする承認取得者の見解は受け入れ可能であると考える。したがって、本剤及
び本剤の後発医薬品の RMP に基づく追加のリスク最小化活動を不要として差し支えないと
考える。
再審査期間中に認められた懸念である「禁忌患者への投与による乳酸アシドーシスの
報告」は現在も散見されるものの、再審査期間終了以降に、乳酸アシドーシスの報告数
が増加している傾向や、禁忌患者への投与時の乳酸アシドーシスの報告数が大幅に増
加している傾向は認められず、新たな安全性の懸念を認める状況とは言えないこと(図
1 及び図 2、並びに表 5 及び表 6 参照)。
MID-NET®調査において、禁忌に係る添付文書改訂後、メトホルミン製剤が新規処方さ
れた中等度の腎機能障害患者への初回投与量の遵守傾向が認められ、また、中等度の腎
機能患者において乳酸アシドーシスの発現は認められなかったことから、現在ではメ
トホルミン製剤が適切に投与されていることが示唆されること。
メトホルミン製剤による乳酸アシドーシスは、本邦の標準的な教科書にも記載されて
おり、医学薬学上公知の情報と考えられること。また、日本糖尿病学会が監修する「ビ
14
本邦において、一般的に承認条件として RMP の策定が付与されている医薬品については、RMP 上のリスクやリスク
最小化の資材の情報が医療現場に十分浸透しているか、新たな安全性の懸念がないか、既存のリスクの発現状況に大
幅な変化がないか等を評価したうえで、問題がないことが確認された場合、RMP の策定が解除される
https://www.pmda.go.jp/safety/info-services/drugs/items-information/rmp/0003.html(最終確認日:2023 年 1 月 25 日)
9