よむ、つかう、まなぶ。
参考資料2 調査結果報告書 (14 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_31125.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第25回 2/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
別添 2
MID-NET®を用いた調査結果の概要
2022 年 12 月 9 日
調査・研究
MID-NET®を用いたメトホルミンの添付文書改訂の影響に関するデータベース調査
の名称
調査対象
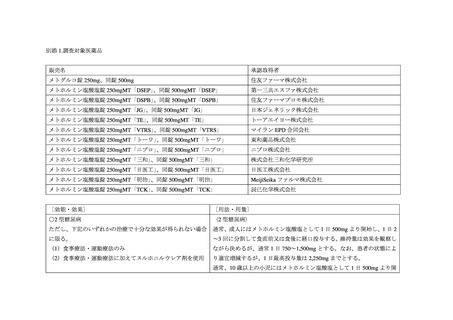
メトホルミン塩酸塩を有効成分とする単剤及び配合剤(以下、「メトホルミン」)
品目
調査背景
1970 年代にフェンホルミン塩酸塩で乳酸アシドーシスによる死亡例が報告されて
から、乳酸アシドーシスのリスクを最小化する目的で、国内外のメトホルミンの添
付文書(以下、「注意事項等情報」)には、対象患者、投与量等を制限する注意喚
起がなされてきた。
2016 年 4 月に米国食品医薬品局、同年 10 月に欧州医薬品庁は、腎機能障害患者に
おけるメトホルミンの投与制限を見直し、軽度から中等度の腎機能障害患者でメト
ホルミンの投与を可能とし、禁忌を推算糸球体濾過量(eGFR[mL/min/1.73 m2])が 30
未満の患者に限定するとともに、軽度から中等度の腎機能障害患者に投与する際の
注意をメトホルミンの注意事項等情報に追加した。
本邦では、2019 年 6 月 18 日にメトホルミンの注意事項等情報において、主に以下
の点が改訂された。
禁忌の対象が中等度以上の腎機能障害患者(eGFR < 60)から重度の腎機能障害
患者(eGFR < 30)に限定され、中等度の腎機能障害患者(30 < eGFR < 60)に
対してもメトホルミンの投与が可能となった。
用法・用量に関連する使用上の注意が新設され、中等度の腎機能障害患者(30
< eGFR < 60)に対し、下記の内容が注意喚起された。
投与は少量より開始すること。
投与中はより頻回に腎機能(eGFR 等)を確認する等、慎重に経過を観察
し、投与の適否及び投与量の調節を検討すること。
1 日最高投与量は、45 < eGFR < 60 の患者では 1,500 mg、30 < eGFR < 45 の
患者では 750 mg を目安とすること。
注意事項等情報改訂後の実臨床におけるメトホルミンの適正使用状況は、定量的に
評価されていない。
調査目的
メトホルミンが処方された患者、主に中等度の腎機能障害患者(30 < eGFR < 60)を対象
に、メトホルミンの注意事項等情報改訂前後で処方実態や乳酸アシドーシスの発現状況
を比較することにより、注意事項等情報の改訂の影響を評価する。
MID-NET® 選定理由
:臨床検査値を指標とした評価を実施するために選択。
の 選 定 理 データ期間 :2009 年 1 月 1 日~2020 年 3 月 31 日。
由とデー
データ期間に利用可能であった MID-NET®協力医療機関(10 拠点 22 病
タ期間
院)のデータを利用
調 査 方 法 調査デザイン:コホートデザイン
の概略
調査対象集団:
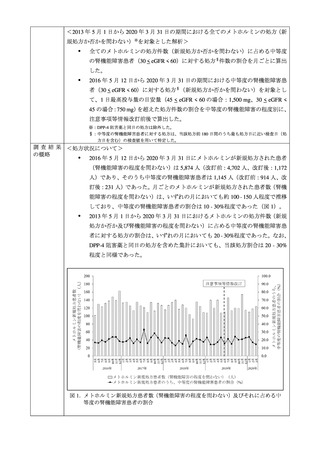
2016 年 5 月 12 日†から 2020 年 3 月 31 日までの期間(組入れ期間)において、メト
ホルミンが新規処方された患者を対象とし、注意事項等情報が改訂された 2019 年 6
月 18 日より前(以下、「改訂前」)又は後(以下、「改訂後」)の期間で患者を分
類した。また、評価の参考とするため、改訂後の期間にジぺプチジルペプチダーゼ
MID-NET®を用いた調査結果の概要
2022 年 12 月 9 日
調査・研究
MID-NET®を用いたメトホルミンの添付文書改訂の影響に関するデータベース調査
の名称
調査対象
メトホルミン塩酸塩を有効成分とする単剤及び配合剤(以下、「メトホルミン」)
品目
調査背景
1970 年代にフェンホルミン塩酸塩で乳酸アシドーシスによる死亡例が報告されて
から、乳酸アシドーシスのリスクを最小化する目的で、国内外のメトホルミンの添
付文書(以下、「注意事項等情報」)には、対象患者、投与量等を制限する注意喚
起がなされてきた。
2016 年 4 月に米国食品医薬品局、同年 10 月に欧州医薬品庁は、腎機能障害患者に
おけるメトホルミンの投与制限を見直し、軽度から中等度の腎機能障害患者でメト
ホルミンの投与を可能とし、禁忌を推算糸球体濾過量(eGFR[mL/min/1.73 m2])が 30
未満の患者に限定するとともに、軽度から中等度の腎機能障害患者に投与する際の
注意をメトホルミンの注意事項等情報に追加した。
本邦では、2019 年 6 月 18 日にメトホルミンの注意事項等情報において、主に以下
の点が改訂された。
禁忌の対象が中等度以上の腎機能障害患者(eGFR < 60)から重度の腎機能障害
患者(eGFR < 30)に限定され、中等度の腎機能障害患者(30 < eGFR < 60)に
対してもメトホルミンの投与が可能となった。
用法・用量に関連する使用上の注意が新設され、中等度の腎機能障害患者(30
< eGFR < 60)に対し、下記の内容が注意喚起された。
投与は少量より開始すること。
投与中はより頻回に腎機能(eGFR 等)を確認する等、慎重に経過を観察
し、投与の適否及び投与量の調節を検討すること。
1 日最高投与量は、45 < eGFR < 60 の患者では 1,500 mg、30 < eGFR < 45 の
患者では 750 mg を目安とすること。
注意事項等情報改訂後の実臨床におけるメトホルミンの適正使用状況は、定量的に
評価されていない。
調査目的
メトホルミンが処方された患者、主に中等度の腎機能障害患者(30 < eGFR < 60)を対象
に、メトホルミンの注意事項等情報改訂前後で処方実態や乳酸アシドーシスの発現状況
を比較することにより、注意事項等情報の改訂の影響を評価する。
MID-NET® 選定理由
:臨床検査値を指標とした評価を実施するために選択。
の 選 定 理 データ期間 :2009 年 1 月 1 日~2020 年 3 月 31 日。
由とデー
データ期間に利用可能であった MID-NET®協力医療機関(10 拠点 22 病
タ期間
院)のデータを利用
調 査 方 法 調査デザイン:コホートデザイン
の概略
調査対象集団:
2016 年 5 月 12 日†から 2020 年 3 月 31 日までの期間(組入れ期間)において、メト
ホルミンが新規処方された患者を対象とし、注意事項等情報が改訂された 2019 年 6
月 18 日より前(以下、「改訂前」)又は後(以下、「改訂後」)の期間で患者を分
類した。また、評価の参考とするため、改訂後の期間にジぺプチジルペプチダーゼ