よむ、つかう、まなぶ。
参考資料2 調査結果報告書 (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_31125.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第25回 2/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
別紙
調査結果報告書
2023 年 2 月 9 日
独立行政法人医薬品医療機器総合機構
I.品目の概要
[一 般
名]
メトホルミン塩酸塩
[販 売
名]
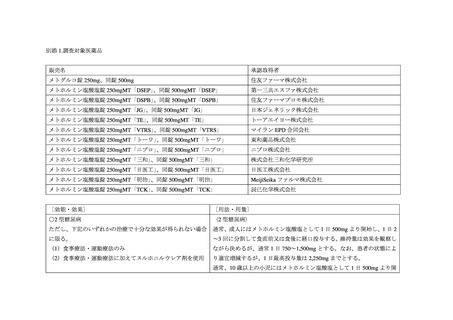
別添 1 のとおり
[承認取得者]
別添 1 のとおり
[効能・効果]
別添 1 のとおり
[用法・用量]
別添 1 のとおり
[備
特になし
考]
[調査担当部]
医薬品安全対策第一部
II. 今回の調査の概略
メトホルミン塩酸塩製剤であるメトグルコ錠(以下、
「本剤」)の製造販売承認(以下、
「承認」)時(2010 年)は、医薬品リスク管理計画指針 1が公表される前であったが、
行政指導により本剤の「リスクマネージメントプラン」が作成された。2014 年、本剤
の小児に対する用法・用量に係る製造販売承認事項一部変更承認(以下、
「一変承認」
)
時に、医薬品リスク管理計画(以下、「RMP」
)が策定・公開された。
通例、承認条件として付与される RMP は、再審査結果を受けて承認条件が満たされた
場合、策定及び公開を終了している。一方、メトグルコ錠は再審査期間中に禁忌患者へ
の投与が散見されたこと等から、2015 年 12 月の再審査終了後も RMP の公開を継続す
ることとされ、現在まで実施されている。また、2015 年 2 月以降に承認された本剤の
後発医薬品も、現在まで RMP が公開されている。RMP に基づく追加のリスク最小化活
動として、医療従事者向け及び患者向け資材の情報提供を行った上で、年 1 回、乳酸ア
シドーシスの副作用報告状況の評価が行われている。
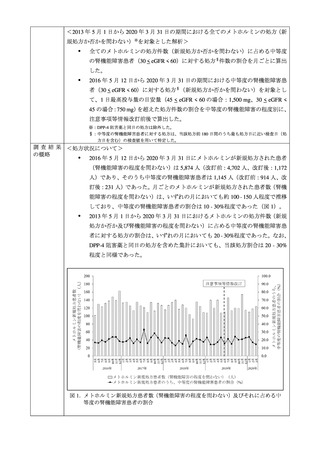
本剤の RMP は策定されてから対応が長期間にわたっており、今般、医療情報データベ
ースシステム(Medical Information Database Network、以下「MID-NET®」)を用いた調査
の結果(別添 2)が得られたこと等から、本剤の承認取得者から、RMP に基づく追加の
リスク最小化活動を必ずしも RMP に基づいて実施する必要性はなく、RMP の終了を
提案する意見書(別添 3)が提出された。
独立行政法人
医薬品医療機器総合機構(以下、
「機構」)は、本剤及び本剤の後発医薬
品に対する RMP 対応の継続の要否に関する調査を行った。
1
https://www.pmda.go.jp/files/000145482.pdf(最終確認日:2023 年 1 月 25 日)
1
調査結果報告書
2023 年 2 月 9 日
独立行政法人医薬品医療機器総合機構
I.品目の概要
[一 般
名]
メトホルミン塩酸塩
[販 売
名]
別添 1 のとおり
[承認取得者]
別添 1 のとおり
[効能・効果]
別添 1 のとおり
[用法・用量]
別添 1 のとおり
[備
特になし
考]
[調査担当部]
医薬品安全対策第一部
II. 今回の調査の概略
メトホルミン塩酸塩製剤であるメトグルコ錠(以下、
「本剤」)の製造販売承認(以下、
「承認」)時(2010 年)は、医薬品リスク管理計画指針 1が公表される前であったが、
行政指導により本剤の「リスクマネージメントプラン」が作成された。2014 年、本剤
の小児に対する用法・用量に係る製造販売承認事項一部変更承認(以下、
「一変承認」
)
時に、医薬品リスク管理計画(以下、「RMP」
)が策定・公開された。
通例、承認条件として付与される RMP は、再審査結果を受けて承認条件が満たされた
場合、策定及び公開を終了している。一方、メトグルコ錠は再審査期間中に禁忌患者へ
の投与が散見されたこと等から、2015 年 12 月の再審査終了後も RMP の公開を継続す
ることとされ、現在まで実施されている。また、2015 年 2 月以降に承認された本剤の
後発医薬品も、現在まで RMP が公開されている。RMP に基づく追加のリスク最小化活
動として、医療従事者向け及び患者向け資材の情報提供を行った上で、年 1 回、乳酸ア
シドーシスの副作用報告状況の評価が行われている。
本剤の RMP は策定されてから対応が長期間にわたっており、今般、医療情報データベ
ースシステム(Medical Information Database Network、以下「MID-NET®」)を用いた調査
の結果(別添 2)が得られたこと等から、本剤の承認取得者から、RMP に基づく追加の
リスク最小化活動を必ずしも RMP に基づいて実施する必要性はなく、RMP の終了を
提案する意見書(別添 3)が提出された。
独立行政法人
医薬品医療機器総合機構(以下、
「機構」)は、本剤及び本剤の後発医薬
品に対する RMP 対応の継続の要否に関する調査を行った。
1
https://www.pmda.go.jp/files/000145482.pdf(最終確認日:2023 年 1 月 25 日)
1