よむ、つかう、まなぶ。
参考資料2 調査結果報告書 (8 ページ)
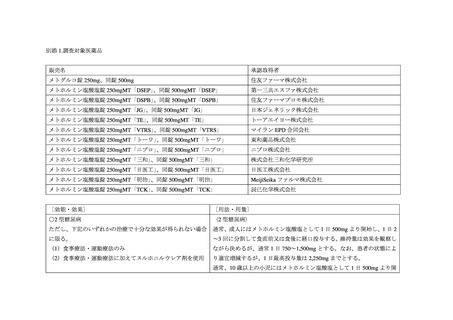
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_31125.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第25回 2/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
60
60.0
(1)の期間
(2)の期間
(3)の期間
50.0
40
40.0
30
30.0
20
20.0
10
10.0
0
割合(%)
例数
50
0.0
2010
2011
2012
2013
2014
2015
2016
2017
2018
2019
2020
2021
2022
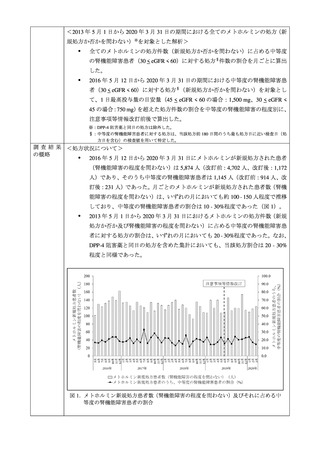
図 2. 乳酸アシドーシスの報告数及び禁忌患者への投与報告数
禁忌患者への投与により乳酸アシドーシスを発現した報告はいずれの年度においても 4
~13 例であった。
各期間の乳酸アシドーシスの報告数、及び乳酸アシドーシスの報告例のうち、投与前に禁
忌に該当した症例数は表 5 のとおりであり、再審査期間中は、乳酸アシドーシスの報告例数
の 40%以上を占めていたが、再審査期間終了以降、その割合は減少した。
表 5. 各期間における乳酸アシドーシスの発現状況
(1)
(2)
乳酸アシドーシスの報告数(自社製品)
53
194
投与前に禁忌に該当した症例数
23(43.4%) 45(23.2%)
※()は乳酸アシドーシスの発現例数に対する割合
(3)
128
29(22.7%)
なお、本剤の再審査時において、乳酸アシドーシスの発現状況の検討対象とされた 80 例
7
のうち、投与前に禁忌であった主な事例は、「心血管系、肺機能に高度の障害(ショック、
心不全、心筋梗塞、肺塞栓等)のある患者及びその他の低酸素血症を伴いやすい状態にある
患者」
(17 例(21.2%)
)、
「中等度以上の腎機能障害」
(12 例(15.0%))であった。また、慎
重投与に該当する主な事例は、
「高齢者(65 歳以上)」
(52 例(65.0%)
)
、
「利尿作用を有する
薬剤との併用」(30 例(37.5%)
)
、「軽度の腎機能障害患者」
(14 例(17.5%))であった。
これらの事例について、各対象期間における例数を集計した結果は、表 6 のとおりであっ
た。なお、
「中等度以上の腎機能障害」は「重度の腎機能障害」及び「中等度の腎機能障害」
への投与として区別して集計した。
7
本剤の再審査においては、2015 年 3 月 31 日までに当局副作用報告が完了した 80 例を検討対象とした。
7
60.0
(1)の期間
(2)の期間
(3)の期間
50.0
40
40.0
30
30.0
20
20.0
10
10.0
0
割合(%)
例数
50
0.0
2010
2011
2012
2013
2014
2015
2016
2017
2018
2019
2020
2021
2022
図 2. 乳酸アシドーシスの報告数及び禁忌患者への投与報告数
禁忌患者への投与により乳酸アシドーシスを発現した報告はいずれの年度においても 4
~13 例であった。
各期間の乳酸アシドーシスの報告数、及び乳酸アシドーシスの報告例のうち、投与前に禁
忌に該当した症例数は表 5 のとおりであり、再審査期間中は、乳酸アシドーシスの報告例数
の 40%以上を占めていたが、再審査期間終了以降、その割合は減少した。
表 5. 各期間における乳酸アシドーシスの発現状況
(1)
(2)
乳酸アシドーシスの報告数(自社製品)
53
194
投与前に禁忌に該当した症例数
23(43.4%) 45(23.2%)
※()は乳酸アシドーシスの発現例数に対する割合
(3)
128
29(22.7%)
なお、本剤の再審査時において、乳酸アシドーシスの発現状況の検討対象とされた 80 例
7
のうち、投与前に禁忌であった主な事例は、「心血管系、肺機能に高度の障害(ショック、
心不全、心筋梗塞、肺塞栓等)のある患者及びその他の低酸素血症を伴いやすい状態にある
患者」
(17 例(21.2%)
)、
「中等度以上の腎機能障害」
(12 例(15.0%))であった。また、慎
重投与に該当する主な事例は、
「高齢者(65 歳以上)」
(52 例(65.0%)
)
、
「利尿作用を有する
薬剤との併用」(30 例(37.5%)
)
、「軽度の腎機能障害患者」
(14 例(17.5%))であった。
これらの事例について、各対象期間における例数を集計した結果は、表 6 のとおりであっ
た。なお、
「中等度以上の腎機能障害」は「重度の腎機能障害」及び「中等度の腎機能障害」
への投与として区別して集計した。
7
本剤の再審査においては、2015 年 3 月 31 日までに当局副作用報告が完了した 80 例を検討対象とした。
7