よむ、つかう、まなぶ。
参考資料2 調査結果報告書 (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_31125.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第25回 2/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
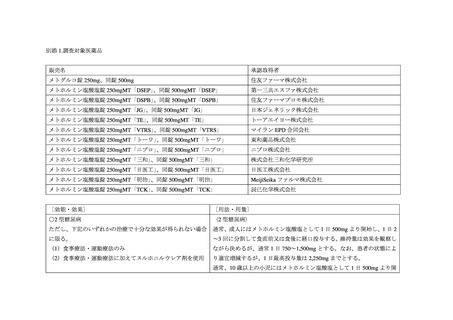
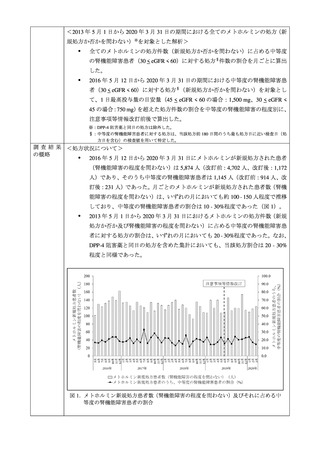
III. 今回の調査の経緯
1.
本剤及び本剤の後発医薬品の添付文書及び RMP の現在までの経緯
① 承認申請時の対応
メトホルミン塩酸塩(以下、
「メトホルミン」)はビグアナイド系糖尿病用薬であり、本邦
では 1961 年 1 月に「糖尿病」を効能・効果、最高用量を 1 日 1,500 mg とする販売名メルビ
ン錠 250 mg 2等のメトホルミン含有医薬品(以下、「メトホルミン製剤」
)が承認された。
1977 年以降、本邦のメトホルミン製剤においては、スルホニルウレア剤が効果不十分な
場合又は副作用等により使用不適当な場合に限る旨の効能・効果及び用法・用量に制限され、
また、最高用量も 1 日 750 mg に減量され、さらに高齢者や腎機能障害患者への投与が禁忌
とされた。
その後、海外における承認状況等から、本邦における効能・効果及び用法・用量の見直し
が行われ、2010 年 1 月 20 日、1 日最高用量を 2,250 mg とするメトグルコ錠 250mg が本邦
で承認された。2012 年 8 月 16 日にはメトグルコ錠 500 mg が本邦で承認された。
既存のメトホルミン製剤では高齢者、軽度の腎機能障害患者、及び軽度から中等度の肝機
能障害患者が禁忌とされていたが、本剤の承認審査時に、国内臨床試験成績等から当該患者
を本剤の禁忌とはせず、使用可能と判断した。一方、当該患者に対して定期的に検査等がな
されていることを承認取得者が把握できるよう、本剤の承認時において「リスクマネージメ
ントプラン」が作成され、医療機関向けの依頼文書や患者指導せんが作成された。
2014 年 8 月 29 日、本剤について 10 歳以上の小児に対する用法・用量に係る一変承認が
なされた。当該一変承認に係る審査の際に、本剤の医薬品リスク管理計画指針
1
に基づく
RMP 案が提出され、一変承認後に本剤の RMP が公表された。
2015 年 2 月 16 日、本剤の後発医薬品が本邦で承認され、2015 年 8 月 12 日には後発医薬
品についても小児に対する用法・用量に係る一変承認がなされた。後発医薬品の承認審査時
において本剤同様に RMP 案が提出され、一変承認後に RMP が公表された。
② 再審査時の対応
2015 年 12 月 24 日、本剤の再審査報告書 3が公表された。本剤の再審査期間中における乳
酸アシドーシスの懸念について、機構は以下のとおり考察した。
添付文書における注意喚起が遵守されず(中等度以上の腎機能障害患者、過度のアルコ
ール摂取者等、禁忌に該当する症例への投与が散見されること)、乳酸アシドーシスを
発現している症例が散見されることから、引き続き禁忌を含めた適正使用に係る情報
の周知が必要である。
2
3
「医療事故を防止するための医薬品の表示事項及び販売名の取扱いについて」
(平成 12 年 9 月 19 日付 医薬発第 935
号)に基づき、販売名をメルビン錠 250 mg に変更するための代替新規申請がなされ、平成 20 年 12 月 3 日に承認さ
れた。
http://www.pmda.go.jp/drugs_reexam/2015/P20151222001/400093000_22200AMX00234_A100_1.pdf(最終確認日:2023 年
1 月 25 日)
2
1.
本剤及び本剤の後発医薬品の添付文書及び RMP の現在までの経緯
① 承認申請時の対応
メトホルミン塩酸塩(以下、
「メトホルミン」)はビグアナイド系糖尿病用薬であり、本邦
では 1961 年 1 月に「糖尿病」を効能・効果、最高用量を 1 日 1,500 mg とする販売名メルビ
ン錠 250 mg 2等のメトホルミン含有医薬品(以下、「メトホルミン製剤」
)が承認された。
1977 年以降、本邦のメトホルミン製剤においては、スルホニルウレア剤が効果不十分な
場合又は副作用等により使用不適当な場合に限る旨の効能・効果及び用法・用量に制限され、
また、最高用量も 1 日 750 mg に減量され、さらに高齢者や腎機能障害患者への投与が禁忌
とされた。
その後、海外における承認状況等から、本邦における効能・効果及び用法・用量の見直し
が行われ、2010 年 1 月 20 日、1 日最高用量を 2,250 mg とするメトグルコ錠 250mg が本邦
で承認された。2012 年 8 月 16 日にはメトグルコ錠 500 mg が本邦で承認された。
既存のメトホルミン製剤では高齢者、軽度の腎機能障害患者、及び軽度から中等度の肝機
能障害患者が禁忌とされていたが、本剤の承認審査時に、国内臨床試験成績等から当該患者
を本剤の禁忌とはせず、使用可能と判断した。一方、当該患者に対して定期的に検査等がな
されていることを承認取得者が把握できるよう、本剤の承認時において「リスクマネージメ
ントプラン」が作成され、医療機関向けの依頼文書や患者指導せんが作成された。
2014 年 8 月 29 日、本剤について 10 歳以上の小児に対する用法・用量に係る一変承認が
なされた。当該一変承認に係る審査の際に、本剤の医薬品リスク管理計画指針
1
に基づく
RMP 案が提出され、一変承認後に本剤の RMP が公表された。
2015 年 2 月 16 日、本剤の後発医薬品が本邦で承認され、2015 年 8 月 12 日には後発医薬
品についても小児に対する用法・用量に係る一変承認がなされた。後発医薬品の承認審査時
において本剤同様に RMP 案が提出され、一変承認後に RMP が公表された。
② 再審査時の対応
2015 年 12 月 24 日、本剤の再審査報告書 3が公表された。本剤の再審査期間中における乳
酸アシドーシスの懸念について、機構は以下のとおり考察した。
添付文書における注意喚起が遵守されず(中等度以上の腎機能障害患者、過度のアルコ
ール摂取者等、禁忌に該当する症例への投与が散見されること)、乳酸アシドーシスを
発現している症例が散見されることから、引き続き禁忌を含めた適正使用に係る情報
の周知が必要である。
2
3
「医療事故を防止するための医薬品の表示事項及び販売名の取扱いについて」
(平成 12 年 9 月 19 日付 医薬発第 935
号)に基づき、販売名をメルビン錠 250 mg に変更するための代替新規申請がなされ、平成 20 年 12 月 3 日に承認さ
れた。
http://www.pmda.go.jp/drugs_reexam/2015/P20151222001/400093000_22200AMX00234_A100_1.pdf(最終確認日:2023 年
1 月 25 日)
2