よむ、つかう、まなぶ。
参考資料2 調査結果報告書 (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_31125.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第25回 2/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
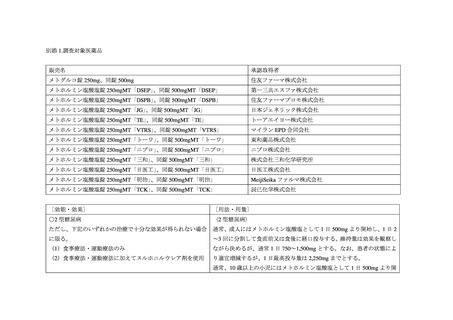
表 6. 投与前に禁忌又は慎重投与であった患者における乳酸アシドーシスの発現状況
(1)
(2)
(3)
乳酸アシドーシスの発現例数
53
194
128
心血管系、肺機能に高度の障害(ショック、心不全、
心筋梗塞、肺塞栓等)のある患者及びその他の低酸 11(20.8%)
16(8.2%)
10(7.8%)
素血症を伴いやすい状態にある患者 8
投与前に重度の腎機能障害 9を合併した患者
4(7.5%)
16(8.2%)
5(3.9%)
投与前に中等度の腎機能障害 10を合併した患者
15(28.3%)
43(22.2%)
6(4.7%)
投与前に軽度の腎機能障害 11を合併した患者
8(15.1%)
24(12.4%)
7(5.5%)
高齢者(65 歳以上) 12
34(64.2%)
96(49.5%)
57(44.5%)
利尿作用を有する薬剤 13との併用
24(45.3%)
50(25.8%)
26(20.3%)
※()は乳酸アシドーシスの発現例数に対する割合
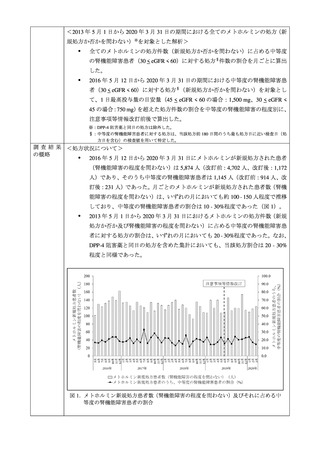
3. MID-NET®を用いた乳酸アシドーシスの発現調査について
MID-NET®調査の結果は別添 2 のとおりであり、主な結果は以下のとおりである。機構は、
禁忌に係る添付文書改訂以降にメトホルミン製剤による乳酸アシドーシスの発現が著しく
増加していないことを確認した。
メトホルミン製剤が新規処方された中等度の腎機能障害患者における、初回処方時の 1
日処方量が通常の開始量(500mg 以下)である患者の割合は、添付文書改訂後に高い傾
向が認められた。
添付文書改訂後にメトホルミンが新規処方された中等度の腎機能障害患者において、
乳酸アシドーシス及び高乳酸血症の発現は認められなかった。
添付文書改訂後にメトホルミンが新規処方された患者(腎機能障害の程度を問わない)
において、改訂前よりも乳酸アシドーシス及び高乳酸血症の発現リスクは高い傾向が
認められたものの、その発現数は限られていた。
4. 糖尿病治療におけるメトホルミン製剤の位置付けについて
機構は、乳酸アシドーシス等のメトホルミン製剤によるリスクの周知状況や、糖尿病用薬
の使用状況の変遷に関する調査を行った。
ビグアナイド系糖尿病用薬の投与による乳酸アシドーシスの発現を避けるために、適切
な患者選択及び患者指導を行うよう、2012 年に日本糖尿病学会は「ビグアナイド薬の適正
使用に関する Recommendation」を発出し、注意喚起を行った。当該 Recommendation は 2016
年に「メトホルミンの適正使用に関する Recommendation」として改訂された。
当該 Recommendation には、メトホルミン製剤投与時における乳酸アシドーシスのリスク
脚注 6 の「心血管系、肺機能に高度の障害(ショック、心不全、心筋梗塞、肺塞栓等)のある患者及びその他の低酸
素血症を伴いやすい状態にある患者」と定義は同じ。
9
乳酸アシドーシス発現前に eGFR が 30 mL/min/1.73m2 未満の症例又は透析を要する症例。
10
乳酸アシドーシス発現前に eGFR が 30 mL/min/1.73m2 以上 60 mL/min/1.73m2 未満の症例。
11
乳酸アシドーシス発現前に eGFR が 60 mL/min/1.73m2 以上 90 mL/min/1.73m2 未満の症例。
12
乳酸アシドーシスの発現時の年齢が 65 歳以上の症例。
13
利尿剤又は SGLT2 阻害剤を併用している症例。
8
8
(1)
(2)
(3)
乳酸アシドーシスの発現例数
53
194
128
心血管系、肺機能に高度の障害(ショック、心不全、
心筋梗塞、肺塞栓等)のある患者及びその他の低酸 11(20.8%)
16(8.2%)
10(7.8%)
素血症を伴いやすい状態にある患者 8
投与前に重度の腎機能障害 9を合併した患者
4(7.5%)
16(8.2%)
5(3.9%)
投与前に中等度の腎機能障害 10を合併した患者
15(28.3%)
43(22.2%)
6(4.7%)
投与前に軽度の腎機能障害 11を合併した患者
8(15.1%)
24(12.4%)
7(5.5%)
高齢者(65 歳以上) 12
34(64.2%)
96(49.5%)
57(44.5%)
利尿作用を有する薬剤 13との併用
24(45.3%)
50(25.8%)
26(20.3%)
※()は乳酸アシドーシスの発現例数に対する割合
3. MID-NET®を用いた乳酸アシドーシスの発現調査について
MID-NET®調査の結果は別添 2 のとおりであり、主な結果は以下のとおりである。機構は、
禁忌に係る添付文書改訂以降にメトホルミン製剤による乳酸アシドーシスの発現が著しく
増加していないことを確認した。
メトホルミン製剤が新規処方された中等度の腎機能障害患者における、初回処方時の 1
日処方量が通常の開始量(500mg 以下)である患者の割合は、添付文書改訂後に高い傾
向が認められた。
添付文書改訂後にメトホルミンが新規処方された中等度の腎機能障害患者において、
乳酸アシドーシス及び高乳酸血症の発現は認められなかった。
添付文書改訂後にメトホルミンが新規処方された患者(腎機能障害の程度を問わない)
において、改訂前よりも乳酸アシドーシス及び高乳酸血症の発現リスクは高い傾向が
認められたものの、その発現数は限られていた。
4. 糖尿病治療におけるメトホルミン製剤の位置付けについて
機構は、乳酸アシドーシス等のメトホルミン製剤によるリスクの周知状況や、糖尿病用薬
の使用状況の変遷に関する調査を行った。
ビグアナイド系糖尿病用薬の投与による乳酸アシドーシスの発現を避けるために、適切
な患者選択及び患者指導を行うよう、2012 年に日本糖尿病学会は「ビグアナイド薬の適正
使用に関する Recommendation」を発出し、注意喚起を行った。当該 Recommendation は 2016
年に「メトホルミンの適正使用に関する Recommendation」として改訂された。
当該 Recommendation には、メトホルミン製剤投与時における乳酸アシドーシスのリスク
脚注 6 の「心血管系、肺機能に高度の障害(ショック、心不全、心筋梗塞、肺塞栓等)のある患者及びその他の低酸
素血症を伴いやすい状態にある患者」と定義は同じ。
9
乳酸アシドーシス発現前に eGFR が 30 mL/min/1.73m2 未満の症例又は透析を要する症例。
10
乳酸アシドーシス発現前に eGFR が 30 mL/min/1.73m2 以上 60 mL/min/1.73m2 未満の症例。
11
乳酸アシドーシス発現前に eGFR が 60 mL/min/1.73m2 以上 90 mL/min/1.73m2 未満の症例。
12
乳酸アシドーシスの発現時の年齢が 65 歳以上の症例。
13
利尿剤又は SGLT2 阻害剤を併用している症例。
8
8