よむ、つかう、まなぶ。
参考資料2 調査結果報告書 (20 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_31125.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第25回 2/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
別添 3
意
見
書
2022 年 12 月 9 日
厚生労働省 医薬・生活衛生局 医薬安全対策課 御中
医薬品医療機器総合機構 医薬品安全対策第一部 御中
住友ファーマ株式会社
安全管理責任者
黒田 倫江
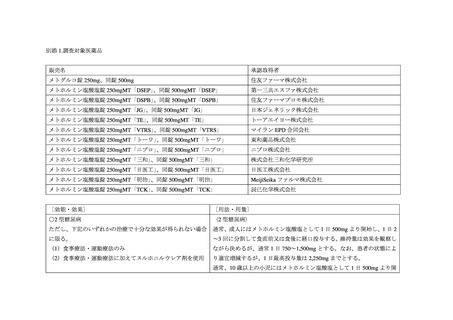
メトグルコ錠の医薬品リスク管理計画書の取り扱いについて
メトグルコ錠(以下、本剤)では、「医薬品リスク管理計画指針について」(平成 24 年 4 月 11 日
付、薬食安発 0411 第 1 号、薬食審査発 0411 第 2 号)の発出により、医薬品リスク管理計画書
(以下、RMP)の制度が運用開始される以前の 2010 年 5 月の販売開始時から、リスクマネジメ
ントプランを策定し、その後は上記通知に基づき RMP を策定、公表して参りました。
本剤では RMP の策定は承認条件となっておらず、また、2014 年 1 月の再審査期間終了後も
RMP を継続し、主として乳酸アシドーシスの発現状況について定期報告書を作成して年 1 回提
出しております。
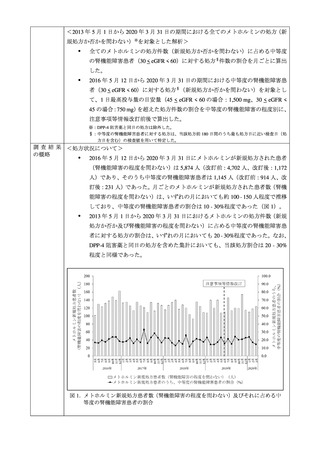
本剤を含むメトホルミン製剤では、2019 年 6 月に中等度腎機能障害患者の禁忌を解除する添付
文書改訂を実施しましたが、今般、医薬品医療機器総合機構にて「MID-NET を用いたメトホル
ミンの添付文書改訂の影響に関するデータベース調査」が実施され、当該添付文書改訂前後
2020 年 3 月末までのデータでの乳酸アシドーシスの発現状況の比較により添付文書改訂の影響
が評価されました。その結果から、メトホルミンによる乳酸アシドーシスの発現は、添付文書改
訂後に著しく増加していないと考えられました。
また、2022 年 7 月、医薬品医療機器総合機構医薬品安全対策第一部より、乳酸アシドーシスの
発現状況に係る照会事項を受領し、本剤発売開始から 2022 年 3 月末までに当社が入手した国内
副作用情報を用いて本剤の再審査期間前後及び 2019 年の添付文書改訂前後での乳酸アシドーシ
スの発現状況を評価した結果、2019 年 6 月の添付文書改訂後も乳酸アシドーシスの発現例数は
増加しておらず、禁忌を解除した中等度の腎機能障害患者及びその他の禁忌又は慎重投与に該当
する患者における新たな安全性上の懸念は認められなかったことを報告しました。
以上より、添付文書改訂後も本剤投与患者での乳酸アシドーシスの発現の増加はみられず、安全
性上の新たな懸念も認められないことから、RMP に基づく医療従事者向け及び患者向け資材の
情報提供を行った上での年 1 回の乳酸アシドーシスの副作用報告状況の評価は不要と考え、本剤
の RMP を終了することを提案いたします。なお、RMP 終了後も、本剤の適正使用のため、医療
関係者向け資材及び患者向け資材の提供を継続すると共に、通常の医薬品安全性監視活動の中で
乳酸アシドーシスの発現状況を把握し、必要に応じて安全対策を検討して参ります。
以上
意
見
書
2022 年 12 月 9 日
厚生労働省 医薬・生活衛生局 医薬安全対策課 御中
医薬品医療機器総合機構 医薬品安全対策第一部 御中
住友ファーマ株式会社
安全管理責任者
黒田 倫江
メトグルコ錠の医薬品リスク管理計画書の取り扱いについて
メトグルコ錠(以下、本剤)では、「医薬品リスク管理計画指針について」(平成 24 年 4 月 11 日
付、薬食安発 0411 第 1 号、薬食審査発 0411 第 2 号)の発出により、医薬品リスク管理計画書
(以下、RMP)の制度が運用開始される以前の 2010 年 5 月の販売開始時から、リスクマネジメ
ントプランを策定し、その後は上記通知に基づき RMP を策定、公表して参りました。
本剤では RMP の策定は承認条件となっておらず、また、2014 年 1 月の再審査期間終了後も
RMP を継続し、主として乳酸アシドーシスの発現状況について定期報告書を作成して年 1 回提
出しております。
本剤を含むメトホルミン製剤では、2019 年 6 月に中等度腎機能障害患者の禁忌を解除する添付
文書改訂を実施しましたが、今般、医薬品医療機器総合機構にて「MID-NET を用いたメトホル
ミンの添付文書改訂の影響に関するデータベース調査」が実施され、当該添付文書改訂前後
2020 年 3 月末までのデータでの乳酸アシドーシスの発現状況の比較により添付文書改訂の影響
が評価されました。その結果から、メトホルミンによる乳酸アシドーシスの発現は、添付文書改
訂後に著しく増加していないと考えられました。
また、2022 年 7 月、医薬品医療機器総合機構医薬品安全対策第一部より、乳酸アシドーシスの
発現状況に係る照会事項を受領し、本剤発売開始から 2022 年 3 月末までに当社が入手した国内
副作用情報を用いて本剤の再審査期間前後及び 2019 年の添付文書改訂前後での乳酸アシドーシ
スの発現状況を評価した結果、2019 年 6 月の添付文書改訂後も乳酸アシドーシスの発現例数は
増加しておらず、禁忌を解除した中等度の腎機能障害患者及びその他の禁忌又は慎重投与に該当
する患者における新たな安全性上の懸念は認められなかったことを報告しました。
以上より、添付文書改訂後も本剤投与患者での乳酸アシドーシスの発現の増加はみられず、安全
性上の新たな懸念も認められないことから、RMP に基づく医療従事者向け及び患者向け資材の
情報提供を行った上での年 1 回の乳酸アシドーシスの副作用報告状況の評価は不要と考え、本剤
の RMP を終了することを提案いたします。なお、RMP 終了後も、本剤の適正使用のため、医療
関係者向け資材及び患者向け資材の提供を継続すると共に、通常の医薬品安全性監視活動の中で
乳酸アシドーシスの発現状況を把握し、必要に応じて安全対策を検討して参ります。
以上