よむ、つかう、まなぶ。
参考資料2 調査結果報告書 (6 ページ)
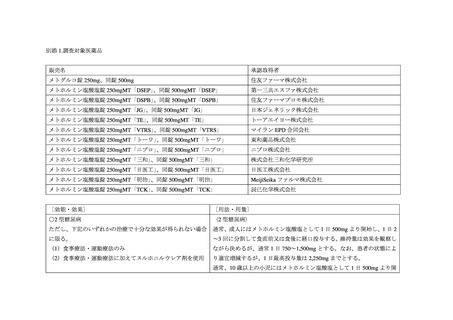
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_31125.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第25回 2/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
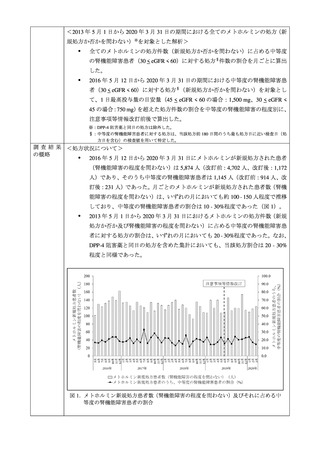
後に発生した乳酸アシドーシスの報告状況 4を調査した。
本邦での乳酸アシドーシスの年度毎(当局報告受付日に基づく)の報告状況(データロッ
ク日:2022 年 11 月 30 日)は図 1 のとおりであった。また、本邦における 2011 年度から
2022 年度まで 5の本剤及び本剤の後発医薬品の推定出荷量の推移も図 1 にて示した。
100
200.00
80
160.00
60
120.00
40
80.00
20
40.00
例数
240.00
推定出荷量(×10,000,000 単位)
120
0.00
0
2010
2011
2012
2013
2014
2015
2016
2017
2018
2019
2020
2021
2022
図 1. 乳酸アシドーシスの報告数*及び推定出荷量**の推移
* 集計定義は脚注 4 を参照。
**Copyright© 2023 IQVIA., JPM 2011 年 5 月-2022 年 12 月をもとに自主分析/Calculated by PMDA based on
May 2011-Dec 2022 JPM, 無断転載禁止/Reprinted with permission
本剤の販売開始以降、2015 年にかけて推定出荷量は増加しており、その後も同程度の出
荷量が維持されている。また、乳酸アシドーシス報告例のうち、各承認取得者により自社製
品と特定された症例数は推定出荷量の増加に伴い 2014 年度まで増加する傾向が認められた
が、その後は年間 26~52 例と概ね一定であり、特段の変動は認められなかった。
また、禁忌に係る添付文書改訂が行われた 2019 年以降、自社製品と特定された報告数、
自社製品か不明の症例数も含めた例数ともに、大幅に報告数が増加する傾向は認められな
かった。
2. 乳酸アシドーシス報告例における禁忌患者への投与状況
本剤の再審査において、禁忌に該当する患者への本剤投与により乳酸アシドーシスを発
現した症例が散見されたこと、及び承認取得者の見解③の妥当性の判断にあたり、機構は、
4
5
本剤又は本剤の後発医薬品の承認取得者が副作用名(MedDRA PT)「乳酸アシドーシス」として機構に報告した国内
重篤副作用報告を対象とし、自社製品の使用例と特定された症例数、及び販売名情報を入手できず自社製品か不明の
症例数を集計した。なお、2010 年度のデータは本剤の販売開始日である 2010 年 5 月 10 日から 2011 年 3 月 31 日ま
で、2022 年度のデータは 2022 年 11 月 30 日までとした。
入手可能な情報から、2011 年 5 月から 2022 年 12 月までのデータを対象とした。
5
本邦での乳酸アシドーシスの年度毎(当局報告受付日に基づく)の報告状況(データロッ
ク日:2022 年 11 月 30 日)は図 1 のとおりであった。また、本邦における 2011 年度から
2022 年度まで 5の本剤及び本剤の後発医薬品の推定出荷量の推移も図 1 にて示した。
100
200.00
80
160.00
60
120.00
40
80.00
20
40.00
例数
240.00
推定出荷量(×10,000,000 単位)
120
0.00
0
2010
2011
2012
2013
2014
2015
2016
2017
2018
2019
2020
2021
2022
図 1. 乳酸アシドーシスの報告数*及び推定出荷量**の推移
* 集計定義は脚注 4 を参照。
**Copyright© 2023 IQVIA., JPM 2011 年 5 月-2022 年 12 月をもとに自主分析/Calculated by PMDA based on
May 2011-Dec 2022 JPM, 無断転載禁止/Reprinted with permission
本剤の販売開始以降、2015 年にかけて推定出荷量は増加しており、その後も同程度の出
荷量が維持されている。また、乳酸アシドーシス報告例のうち、各承認取得者により自社製
品と特定された症例数は推定出荷量の増加に伴い 2014 年度まで増加する傾向が認められた
が、その後は年間 26~52 例と概ね一定であり、特段の変動は認められなかった。
また、禁忌に係る添付文書改訂が行われた 2019 年以降、自社製品と特定された報告数、
自社製品か不明の症例数も含めた例数ともに、大幅に報告数が増加する傾向は認められな
かった。
2. 乳酸アシドーシス報告例における禁忌患者への投与状況
本剤の再審査において、禁忌に該当する患者への本剤投与により乳酸アシドーシスを発
現した症例が散見されたこと、及び承認取得者の見解③の妥当性の判断にあたり、機構は、
4
5
本剤又は本剤の後発医薬品の承認取得者が副作用名(MedDRA PT)「乳酸アシドーシス」として機構に報告した国内
重篤副作用報告を対象とし、自社製品の使用例と特定された症例数、及び販売名情報を入手できず自社製品か不明の
症例数を集計した。なお、2010 年度のデータは本剤の販売開始日である 2010 年 5 月 10 日から 2011 年 3 月 31 日ま
で、2022 年度のデータは 2022 年 11 月 30 日までとした。
入手可能な情報から、2011 年 5 月から 2022 年 12 月までのデータを対象とした。
5