よむ、つかう、まなぶ。
参考資料2 調査結果報告書 (4 ページ)
出典
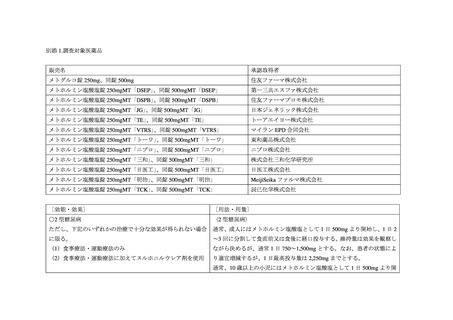
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_31125.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第25回 2/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
本剤投与開始後に禁忌、慎重投与に該当する状態になった症例も認められていること
から、引き続き、本剤投与開始後も腎機能や脱水状態等の患者の状態に注意が必要であ
る旨、乳酸アシドーシスの初期症状が認められた場合は直ちに受診するよう患者に指
導することが重要である旨の情報提供活動を継続する必要がある。
本剤の再審査における状況を踏まえ、本剤の RMP は継続され、RMP に基づきリスク最小
化活動が現在まで実施されている。本剤の後発医薬品についても同様に RMP が現在も継続
され、同様のリスク最小化活動が実施されている。
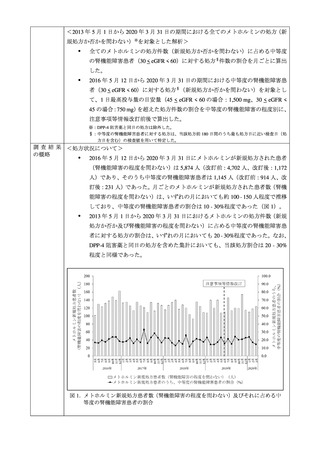
③ 中等度の腎機能障害患者の禁忌解除に係る添付文書改訂
2019 年 6 月 18 日、米国や EU の状況、国内外の複数の診療ガイドライン、薬物動態臨床
試験の結果等を踏まえ、中等度の腎機能障害患者(eGFR 30-60 mL/min/1.73m2)をメトホ
ルミン製剤の禁忌とはせず使用可能とし、当該患者への投与時の注意喚起が添付文書に追
加された。その後、機構は、中等度の腎機能障害患者に係る添付文書改訂の実臨床における
影響を評価することを目的に、MID-NET®を用いて、添付文書改訂前後でのメトホルミン製
剤の処方実態や乳酸アシドーシスの発現状況を比較する調査を行った(当該結果は別添 2 参
照)。
2. 現在の RMP の設定状況
現在の RMP における安全性検討事項、並びに RMP における医薬品安全性監視活動及び
リスク最小化活動は表 1 及び表 2 のとおりである。
重要な特定されたリスク
・乳酸アシドーシス
・低血糖
・消化器症状
・肝機能障害・黄疸
・横紋筋融解症
表 1. RMP における安全性検討事項
重要な潜在的リスク
なし
なし
重要な不足情報
表 2. RMP における医薬品安全性監視活動及びリスク最小化活動
医薬品安全性監視活動
リスク最小化活動
通常のリスク最小化活動
通常の医薬品安全性監視活動
・副作用、文献・学会情報及び海外 ・電子添文及び患者向医薬品ガイドによる情報提供
措置報告等の収集・確認・分析に
基づく安全対策の検討(及び実行)
追加の医薬品安全性監視活動
追加のリスク最小化活動
該当せず
・医療関係者向け資材の提供
・患者向け資材の提供
・乳酸アシドーシスの発現状況及びリスク因子等の年 1
回の検討、並びに医薬品医療機器総合機構への検討結
果の報告
3
本剤投与開始後に禁忌、慎重投与に該当する状態になった症例も認められていること
から、引き続き、本剤投与開始後も腎機能や脱水状態等の患者の状態に注意が必要であ
る旨、乳酸アシドーシスの初期症状が認められた場合は直ちに受診するよう患者に指
導することが重要である旨の情報提供活動を継続する必要がある。
本剤の再審査における状況を踏まえ、本剤の RMP は継続され、RMP に基づきリスク最小
化活動が現在まで実施されている。本剤の後発医薬品についても同様に RMP が現在も継続
され、同様のリスク最小化活動が実施されている。
③ 中等度の腎機能障害患者の禁忌解除に係る添付文書改訂
2019 年 6 月 18 日、米国や EU の状況、国内外の複数の診療ガイドライン、薬物動態臨床
試験の結果等を踏まえ、中等度の腎機能障害患者(eGFR 30-60 mL/min/1.73m2)をメトホ
ルミン製剤の禁忌とはせず使用可能とし、当該患者への投与時の注意喚起が添付文書に追
加された。その後、機構は、中等度の腎機能障害患者に係る添付文書改訂の実臨床における
影響を評価することを目的に、MID-NET®を用いて、添付文書改訂前後でのメトホルミン製
剤の処方実態や乳酸アシドーシスの発現状況を比較する調査を行った(当該結果は別添 2 参
照)。
2. 現在の RMP の設定状況
現在の RMP における安全性検討事項、並びに RMP における医薬品安全性監視活動及び
リスク最小化活動は表 1 及び表 2 のとおりである。
重要な特定されたリスク
・乳酸アシドーシス
・低血糖
・消化器症状
・肝機能障害・黄疸
・横紋筋融解症
表 1. RMP における安全性検討事項
重要な潜在的リスク
なし
なし
重要な不足情報
表 2. RMP における医薬品安全性監視活動及びリスク最小化活動
医薬品安全性監視活動
リスク最小化活動
通常のリスク最小化活動
通常の医薬品安全性監視活動
・副作用、文献・学会情報及び海外 ・電子添文及び患者向医薬品ガイドによる情報提供
措置報告等の収集・確認・分析に
基づく安全対策の検討(及び実行)
追加の医薬品安全性監視活動
追加のリスク最小化活動
該当せず
・医療関係者向け資材の提供
・患者向け資材の提供
・乳酸アシドーシスの発現状況及びリスク因子等の年 1
回の検討、並びに医薬品医療機器総合機構への検討結
果の報告
3