よむ、つかう、まなぶ。
資料2-1 医薬品等の使用上の注意の改訂について (15 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_31510.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第4回 3/2)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
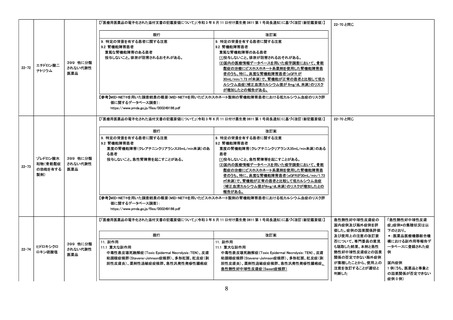
【「医療用医薬品の電子化された添付文書の記載要領について」(令和3年6月11日付け薬生発0611第1号局長通知)に基づく改訂(新記載要領)】
現行
22-83
不活化ポリオワ
クチン(ソークワ
クチン)
631 ワクチン
類
7. 用法及び用量に関連する注意
接種対象者・接種時期
本剤の接種は、通常、生後3か月から90か月までの間にある者に
行うが、初回免疫については、標準として生後3か月から12か月ま
での者に3~8週間の間隔で、追加免疫については、標準として初
回免疫終了後12か月から18か月を経過した者に接種する。
※
改訂案
7. 用法及び用量に関連する注意
接種対象者・接種時期
本剤の接種は、通常、生後2か月から90か月までの間にある者に
行うが、初回免疫については、標準として生後2か月から12か月ま
での者に3~8週間の間隔で、追加免疫については、標準として初
回免疫終了後12か月から18か月を経過した者に接種する。
令和5年4月1日に改訂予定
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】
現行
22-84
沈降精製百日
せきジフテリア
破傷風混合ワ
クチン
636 混合生物
学的製剤
改訂案
令和5年4月1日に改訂予定
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】
22-85
636 混合生物
学的製剤
22-83 と同じ
7. 用法及び用量に関連する注意
7. 用法及び用量に関連する注意
接種対象者・接種時期
接種対象者・接種時期
本剤を第1期の予防接種に使用する場合、生後3か月から90か月ま
本剤を第1期の予防接種に使用する場合、生後2か月から90か月ま
での間にある者に行うが、初回免疫については、標準として生後3
での間にある者に行うが、初回免疫については、標準として生後2
か月から12か月までの者に、追加免疫については、標準として初回
か月から12か月までの者に、追加免疫については、標準として初回
免疫終了後12か月から18か月を経過した者に接種する。
免疫終了後12か月から18か月を経過した者に接種する。
なお、被接種者が保育所、幼稚園等の集団生活に入る場合には、
なお、被接種者が保育所、幼稚園等の集団生活に入る場合には、
その前に接種を完了することが望ましい。
その前に接種を完了することが望ましい。
以後の小児への追加免疫においては、標準として11歳以上13歳未
以後の小児への追加免疫においては、標準として11歳以上13歳未
満の者に0.5mLを1回接種すること。また、成人への追加免疫は、通
満の者に0.5mLを1回接種すること。また、成人への追加免疫は、通
常、1回0.5mLを接種すること。
常、1回0.5mLを接種すること。
※
沈降精製百日
せきジフテリア
破傷風不活化
ポリオ(セービ
ン株)混合ワク
チン
令和4年度第 17 回薬事・食品
衛生審議会医薬品第二部会
(令和5年2月 27 日開催)にお
ける議論結果等を踏まえ、使
用上の注意を改訂することが
適切と判断した。
現行
改訂案
7. 用法及び用量に関連する注意
接種対象者・接種時期
本剤の接種は、生後3か月から90か月までの間にある者に行うが、
初回免疫については、標準として生後3か月から12か月までの者に
3~8週間の間隔で、追加免疫については、標準として初回免疫終
了後12か月から18か月を経過した者に接種する。
なお、被接種者が保育所、幼稚園等の集団生活に入る場合には、
その前に接種を完了することが望ましい。
7. 用法及び用量に関連する注意
接種対象者・接種時期
本剤の接種は、生後2か月から90か月までの間にある者に行うが、
初回免疫については、標準として生後2か月から12か月までの者に
3~8週間の間隔で、追加免疫については、標準として初回免疫終
了後12か月から18か月を経過した者に接種する。
なお、被接種者が保育所、幼稚園等の集団生活に入る場合には、
その前に接種を完了することが望ましい。
※
令和5年4月1日に改訂予定
15
22-83 と同じ
-
現行
22-83
不活化ポリオワ
クチン(ソークワ
クチン)
631 ワクチン
類
7. 用法及び用量に関連する注意
接種対象者・接種時期
本剤の接種は、通常、生後3か月から90か月までの間にある者に
行うが、初回免疫については、標準として生後3か月から12か月ま
での者に3~8週間の間隔で、追加免疫については、標準として初
回免疫終了後12か月から18か月を経過した者に接種する。
※
改訂案
7. 用法及び用量に関連する注意
接種対象者・接種時期
本剤の接種は、通常、生後2か月から90か月までの間にある者に
行うが、初回免疫については、標準として生後2か月から12か月ま
での者に3~8週間の間隔で、追加免疫については、標準として初
回免疫終了後12か月から18か月を経過した者に接種する。
令和5年4月1日に改訂予定
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】
現行
22-84
沈降精製百日
せきジフテリア
破傷風混合ワ
クチン
636 混合生物
学的製剤
改訂案
令和5年4月1日に改訂予定
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】
22-85
636 混合生物
学的製剤
22-83 と同じ
7. 用法及び用量に関連する注意
7. 用法及び用量に関連する注意
接種対象者・接種時期
接種対象者・接種時期
本剤を第1期の予防接種に使用する場合、生後3か月から90か月ま
本剤を第1期の予防接種に使用する場合、生後2か月から90か月ま
での間にある者に行うが、初回免疫については、標準として生後3
での間にある者に行うが、初回免疫については、標準として生後2
か月から12か月までの者に、追加免疫については、標準として初回
か月から12か月までの者に、追加免疫については、標準として初回
免疫終了後12か月から18か月を経過した者に接種する。
免疫終了後12か月から18か月を経過した者に接種する。
なお、被接種者が保育所、幼稚園等の集団生活に入る場合には、
なお、被接種者が保育所、幼稚園等の集団生活に入る場合には、
その前に接種を完了することが望ましい。
その前に接種を完了することが望ましい。
以後の小児への追加免疫においては、標準として11歳以上13歳未
以後の小児への追加免疫においては、標準として11歳以上13歳未
満の者に0.5mLを1回接種すること。また、成人への追加免疫は、通
満の者に0.5mLを1回接種すること。また、成人への追加免疫は、通
常、1回0.5mLを接種すること。
常、1回0.5mLを接種すること。
※
沈降精製百日
せきジフテリア
破傷風不活化
ポリオ(セービ
ン株)混合ワク
チン
令和4年度第 17 回薬事・食品
衛生審議会医薬品第二部会
(令和5年2月 27 日開催)にお
ける議論結果等を踏まえ、使
用上の注意を改訂することが
適切と判断した。
現行
改訂案
7. 用法及び用量に関連する注意
接種対象者・接種時期
本剤の接種は、生後3か月から90か月までの間にある者に行うが、
初回免疫については、標準として生後3か月から12か月までの者に
3~8週間の間隔で、追加免疫については、標準として初回免疫終
了後12か月から18か月を経過した者に接種する。
なお、被接種者が保育所、幼稚園等の集団生活に入る場合には、
その前に接種を完了することが望ましい。
7. 用法及び用量に関連する注意
接種対象者・接種時期
本剤の接種は、生後2か月から90か月までの間にある者に行うが、
初回免疫については、標準として生後2か月から12か月までの者に
3~8週間の間隔で、追加免疫については、標準として初回免疫終
了後12か月から18か月を経過した者に接種する。
なお、被接種者が保育所、幼稚園等の集団生活に入る場合には、
その前に接種を完了することが望ましい。
※
令和5年4月1日に改訂予定
15
22-83 と同じ
-