よむ、つかう、まなぶ。
【資料3-1】鹿野参考人提出資料:小児がん及び小児希少難治性疾患に係る医薬品開発の推進制度に資する調査研究 (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00028.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第1回 7/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
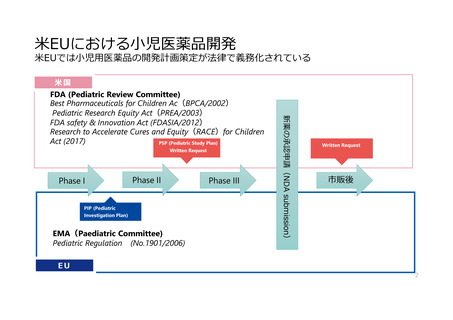
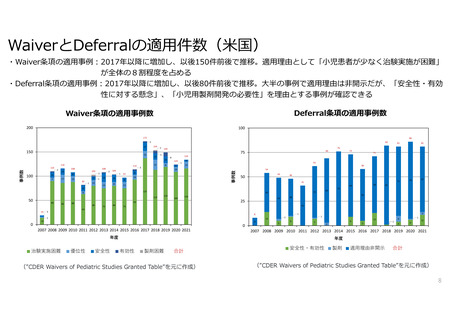
米EUにおける小児医薬品開発
米EUでは小児用医薬品の開発計画策定が法律で義務化されている
米国
Written Request
Phase I
Phase II
PIP (Pediatric
Investigation Plan)
EMA(Paediatric Committee)
Pediatric Regulation (No.1901/2006)
Phase III
新薬の承認申請(NDA submission)
FDA (Pediatric Review Committee)
Best Pharmaceuticals for Children Ac(BPCA/2002)
Pediatric Research Equity Act(PREA/2003)
FDA safety & Innovation Act (FDASIA/2012)
Research to Accelerate Cures and Equity(RACE)for Children
Act (2017)
PSP (Pediatric Study Plan)
Written Request
市販後
EU
2
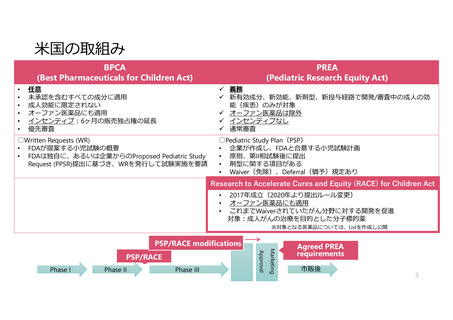
米EUでは小児用医薬品の開発計画策定が法律で義務化されている
米国
Written Request
Phase I
Phase II
PIP (Pediatric
Investigation Plan)
EMA(Paediatric Committee)
Pediatric Regulation (No.1901/2006)
Phase III
新薬の承認申請(NDA submission)
FDA (Pediatric Review Committee)
Best Pharmaceuticals for Children Ac(BPCA/2002)
Pediatric Research Equity Act(PREA/2003)
FDA safety & Innovation Act (FDASIA/2012)
Research to Accelerate Cures and Equity(RACE)for Children
Act (2017)
PSP (Pediatric Study Plan)
Written Request
市販後
EU
2