よむ、つかう、まなぶ。
【資料3-1】鹿野参考人提出資料:小児がん及び小児希少難治性疾患に係る医薬品開発の推進制度に資する調査研究 (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00028.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第1回 7/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
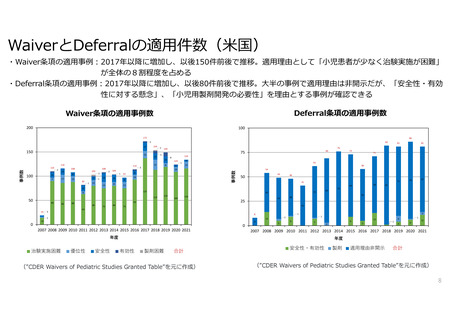
小児用医薬品制度の日米EU比較
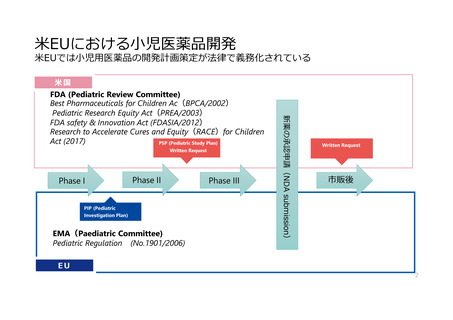
欧米では、成人の開発過程における小児開発の検討は法律で義務化されている
(Waiver(免除)・Deferral(猶予)の規定あり)
日本
米国
EU
制度
• 薬機法及び再審査期間の取扱いについての
審査管理課長通知(令和2年8月31日)
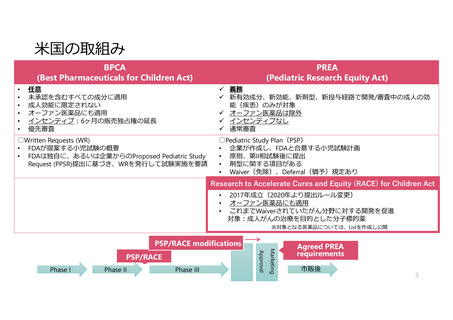
• BPCA (2002) : Best Pharmaceuticals for
Children Act
• PREA (2003) : Pediatric Research Equity
Act
• FDASIA (2012) : FDA Safety & Innovation
Act
• RACE for Children Act (2017)
• Paediatric Regulation (EC) No 1901/2006
(2007)
小児開発の
検討
• 医療上の必要性の高い未承認薬・適応外薬
検討会議による
開発要請
• 成人対象の第Ⅱ相試験終了までに小児試験
計画(PSP)を提出(義務)(PREA)
• FDAの試験実施要請(WR)に応じた小児
用医薬品開発(任意)(BPCA)
• 小児がんの治療可能性のある分子標的薬に
もPSPの提出を求める(RACE)
• 成人対象の第Ⅰ相試験終了までに小児開発
計画(PIP)の提出(義務)
• 6か月間の販売独占権の延長(BPCA)
• 優先審査バウチャー(Rare Pediatric
Disease Priority Review Voucher
Program)
• NICHDを通じた小児試験への研究助成、小
児試験ネットワーク
• 新薬/特許期間中の医薬品:6か月の特許補
完証明期間延長
• オーファン医薬品:2年間の市場独占期間
追加
• 特許切れ既承認医薬品:PUMAによる8年
間の小児開発データ保護及び10年間の販売
独占権
インセンティブ等
•
•
•
•
•
•
再審査期間の延長
薬価加算(5~20%)
オーファン医薬品の開発助成
小児治験ネットワーク
小児医薬品開発ネットワーク事業
特定用途医薬品等指定制度
5
欧米では、成人の開発過程における小児開発の検討は法律で義務化されている
(Waiver(免除)・Deferral(猶予)の規定あり)
日本
米国
EU
制度
• 薬機法及び再審査期間の取扱いについての
審査管理課長通知(令和2年8月31日)
• BPCA (2002) : Best Pharmaceuticals for
Children Act
• PREA (2003) : Pediatric Research Equity
Act
• FDASIA (2012) : FDA Safety & Innovation
Act
• RACE for Children Act (2017)
• Paediatric Regulation (EC) No 1901/2006
(2007)
小児開発の
検討
• 医療上の必要性の高い未承認薬・適応外薬
検討会議による
開発要請
• 成人対象の第Ⅱ相試験終了までに小児試験
計画(PSP)を提出(義務)(PREA)
• FDAの試験実施要請(WR)に応じた小児
用医薬品開発(任意)(BPCA)
• 小児がんの治療可能性のある分子標的薬に
もPSPの提出を求める(RACE)
• 成人対象の第Ⅰ相試験終了までに小児開発
計画(PIP)の提出(義務)
• 6か月間の販売独占権の延長(BPCA)
• 優先審査バウチャー(Rare Pediatric
Disease Priority Review Voucher
Program)
• NICHDを通じた小児試験への研究助成、小
児試験ネットワーク
• 新薬/特許期間中の医薬品:6か月の特許補
完証明期間延長
• オーファン医薬品:2年間の市場独占期間
追加
• 特許切れ既承認医薬品:PUMAによる8年
間の小児開発データ保護及び10年間の販売
独占権
インセンティブ等
•
•
•
•
•
•
再審査期間の延長
薬価加算(5~20%)
オーファン医薬品の開発助成
小児治験ネットワーク
小児医薬品開発ネットワーク事業
特定用途医薬品等指定制度
5