よむ、つかう、まなぶ。
【資料3-1】鹿野参考人提出資料:小児がん及び小児希少難治性疾患に係る医薬品開発の推進制度に資する調査研究 (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00028.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第1回 7/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
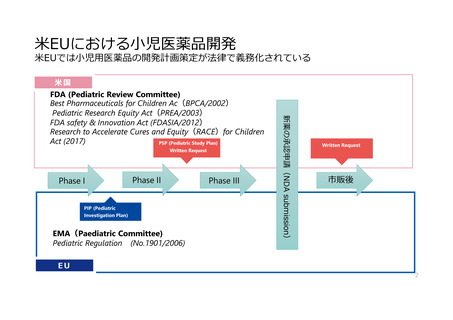
EUの取組み
年
2007
規制
内容
-Paediatric Committee(PDCO)設立
-新薬における小児開発の義務化(PIP提出)
-インセンティブ規定
Paediatric Regulation
(EU)No 1901/2006
Paediatric Investigation Plan(PIP)
インセンティブ
・企業が作成し、EMAと合意した小児開発計画
新薬/特許期間中の医薬品:6ヶ月の特許期間延長
・第I相試験後に提出
・成人の承認申請時の添付資料にEMAと合意したPIPを含める
・剤型に関する項目がある
・Waiver(免除)、Deferral(猶予)規定あり
PIP
Phase II
Phase III
特許切れ既承認医薬品:Paediatric Use Marketing Authorization
(PUMA)に申請し承認されれば、小児開発データ保護(8年)、販売
独占権(10年)
Approved PIP
NDA
submission
Phase I
PIP modifications
オーファン指定医薬品:2年の市場独占期間追加
市販後
4
年
2007
規制
内容
-Paediatric Committee(PDCO)設立
-新薬における小児開発の義務化(PIP提出)
-インセンティブ規定
Paediatric Regulation
(EU)No 1901/2006
Paediatric Investigation Plan(PIP)
インセンティブ
・企業が作成し、EMAと合意した小児開発計画
新薬/特許期間中の医薬品:6ヶ月の特許期間延長
・第I相試験後に提出
・成人の承認申請時の添付資料にEMAと合意したPIPを含める
・剤型に関する項目がある
・Waiver(免除)、Deferral(猶予)規定あり
PIP
Phase II
Phase III
特許切れ既承認医薬品:Paediatric Use Marketing Authorization
(PUMA)に申請し承認されれば、小児開発データ保護(8年)、販売
独占権(10年)
Approved PIP
NDA
submission
Phase I
PIP modifications
オーファン指定医薬品:2年の市場独占期間追加
市販後
4