よむ、つかう、まなぶ。
別紙2及び会議後指摘事項に対する回答 (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24171.html |
| 出典情報 | 先進医療会議 先進医療技術審査部会(第130回 3/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
先進医療審査の事前照会事項に対する回答5
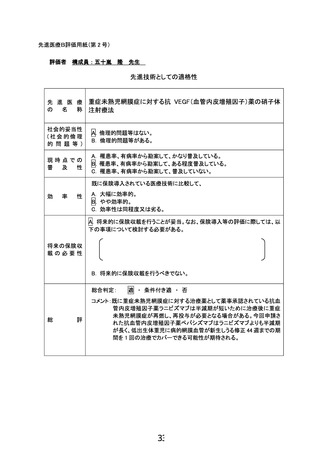
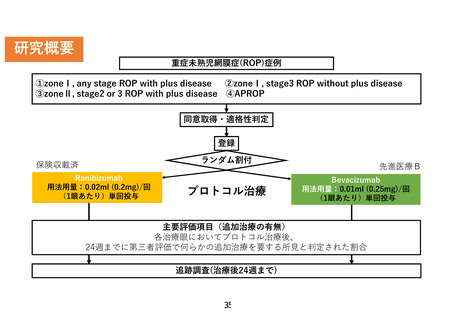
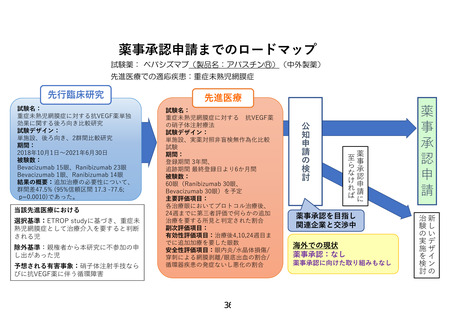
先進医療技術名: 重症未熟児網膜症に対する抗 VEGF(血管内皮増殖因子)薬の硝子体注射療法
2022 年 2 月 22 日
所属・氏名:神戸大学医学部附属病院 眼科・上田 香織
※照会に伴い変更が生じた場合は、関係書類も併せて修正して下さい。
1.(照会回答 3-12 に関連して)
即、失明や大幅な視野欠損に繋がるイベントばかりではないのかもしれないが、非可逆的障害が
残る可能性が高まるのであれば、ベバシズマブがラニビズマブに優越できる可能性が(0%になった
時点ではなく)ある程度まで低くなった時点で新規登録を中止、あるいは、せめて一旦登録を停止し
て適格基準の見直し等を行うか試験継続の可否を検討するという規定を盛り込むべきではないか。
なお、照会回答 3-13 で片側検定での評価を行うよう変更しているので、群間のキーオープンをした
中間解析で無効中止のみの検討を行う場合には多重性の調整を不要とすることも選択肢のひとつ
と考える。
本技術については、先行例の情報が少ないことを考え合わせると、①他の照会事項で既に対応
が追加された主治医の判定と第三者的評価との乖離があった事例の速やかな共有(モニタリングの
一環としての対応)に加え、②想定外の有害事象が発生した場合の新規患者の登録中止ないしは
登録中止の必要性や試験実施計画改訂の必要性の検討の規定、更に③上述のベバシズマブの有
効性が不十分であった際に新規患者の登録の中止ないしは登録中止の必要性や試験実施計画改
訂の必要性の検討の規定の 3 つの観点から、適切な被験者保護が可能となる規定を盛り込むべき
ではないか。
【回答】
ご指摘ありがとうございます。本研究が承認薬と適応外使用薬の比較であることについて改めて検討
し、ご指摘の様に独立データモニタリング委員会を設置し、適応外使用薬であるベバシズマブが適応外
使用薬であるラニビズマブに優越できる可能性等について定期的に検討することといたしました。
ご指摘の3点につきまして、「独立データモニタリング委員会に関する手順書」を整備し、以下の対応と
いたします。
「①他の照会事項で既に対応が追加された主治医の判定と第三者的評価との乖離があった事例の
速やかな共有」につきましては、乖離があった場合は研究責任医師へ報告されることとなっていますの
で、その場合には研究責任医師より独立データモニタリング委員会へ随時報告することといたします。
「②想定外の有害事象が発生した場合の新規患者の登録中止ないしは登録中止の必要性や試験実
施計画改訂の必要性の検討の規定」につきましては、各群 3 例が登録された時点で、有害事象が想定
を超えるものではないかについて検討を行います。また、有害事象が当初の想定を超えて発生した場合
には研究責任医師から独立データモニタリング委員会に研究継続の是非を諮るようにいたします。
1
17
先進医療技術名: 重症未熟児網膜症に対する抗 VEGF(血管内皮増殖因子)薬の硝子体注射療法
2022 年 2 月 22 日
所属・氏名:神戸大学医学部附属病院 眼科・上田 香織
※照会に伴い変更が生じた場合は、関係書類も併せて修正して下さい。
1.(照会回答 3-12 に関連して)
即、失明や大幅な視野欠損に繋がるイベントばかりではないのかもしれないが、非可逆的障害が
残る可能性が高まるのであれば、ベバシズマブがラニビズマブに優越できる可能性が(0%になった
時点ではなく)ある程度まで低くなった時点で新規登録を中止、あるいは、せめて一旦登録を停止し
て適格基準の見直し等を行うか試験継続の可否を検討するという規定を盛り込むべきではないか。
なお、照会回答 3-13 で片側検定での評価を行うよう変更しているので、群間のキーオープンをした
中間解析で無効中止のみの検討を行う場合には多重性の調整を不要とすることも選択肢のひとつ
と考える。
本技術については、先行例の情報が少ないことを考え合わせると、①他の照会事項で既に対応
が追加された主治医の判定と第三者的評価との乖離があった事例の速やかな共有(モニタリングの
一環としての対応)に加え、②想定外の有害事象が発生した場合の新規患者の登録中止ないしは
登録中止の必要性や試験実施計画改訂の必要性の検討の規定、更に③上述のベバシズマブの有
効性が不十分であった際に新規患者の登録の中止ないしは登録中止の必要性や試験実施計画改
訂の必要性の検討の規定の 3 つの観点から、適切な被験者保護が可能となる規定を盛り込むべき
ではないか。
【回答】
ご指摘ありがとうございます。本研究が承認薬と適応外使用薬の比較であることについて改めて検討
し、ご指摘の様に独立データモニタリング委員会を設置し、適応外使用薬であるベバシズマブが適応外
使用薬であるラニビズマブに優越できる可能性等について定期的に検討することといたしました。
ご指摘の3点につきまして、「独立データモニタリング委員会に関する手順書」を整備し、以下の対応と
いたします。
「①他の照会事項で既に対応が追加された主治医の判定と第三者的評価との乖離があった事例の
速やかな共有」につきましては、乖離があった場合は研究責任医師へ報告されることとなっていますの
で、その場合には研究責任医師より独立データモニタリング委員会へ随時報告することといたします。
「②想定外の有害事象が発生した場合の新規患者の登録中止ないしは登録中止の必要性や試験実
施計画改訂の必要性の検討の規定」につきましては、各群 3 例が登録された時点で、有害事象が想定
を超えるものではないかについて検討を行います。また、有害事象が当初の想定を超えて発生した場合
には研究責任医師から独立データモニタリング委員会に研究継続の是非を諮るようにいたします。
1
17