よむ、つかう、まなぶ。
別紙2及び会議後指摘事項に対する回答 (25 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24171.html |
| 出典情報 | 先進医療会議 先進医療技術審査部会(第130回 3/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
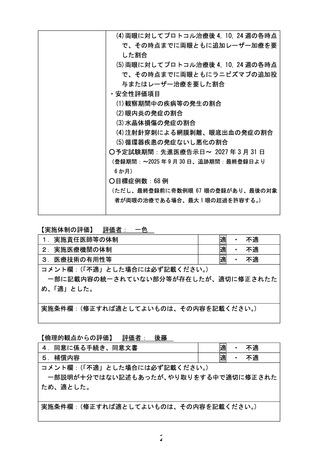
タモニタリング委員会への報告と共に、委員会の判断も含め 6 か月ごとにとりまとめを行い、研究組織
内での共有を行うことといたします。
3.(照会回答 5-1 に関連して)
「②想定外の有害事象が発生した場合の新規患者の登録中止ないしは登録中止の必要性や試
験実施計画改訂の必要性の検討の規定」の各群 3 例が登録された時点での検討を行うという対応
は良いが、眼科領域の事象に留まらない有害事象・副作用が発現した場合に適切に情報を収集し、
速やかに独立データモニタリング委員会、研究組織内で共有するために、予め有無を確認すべき事
象名を CRF に列記して情報を得る方式と、そこに列記されていない事象を個別に報告する方式とを
組み合わせて安全性情報を収集し、適宜リスクの評価を行うことが必要と考える。これに関連して、
安全性の確認のために、独立データモニタリング委員会の委員としてのみならず、各被験者の観察
に小児科の医師が(研究組織の一員として)関与することの必要性について検討されたい。また、研
究責任医師が問題と判断しない事象や発現頻度・グレードの違いが生じている事象についての第三
者的検討が可能になること等から、個別の報告に加え一定期間ごとに取りまとめを行い(例えば○ヶ
月毎、○例毎、など)、都度、独立データモニタリング委員会、研究組織内で共有することも検討され
たい(ただし、研究組織内の共有にあたっては一部の情報のマスキング等が必要になる可能性はあ
る)。
【回答】
ご指摘をいただきありがとうございます。眼科領域の事象に留まらない有害事象・副作用が発現した
場合に適切に情報を収集するため、CRF 内に全身性の重篤な合併症(呼吸不全、窒息、心筋梗塞、そ
の他心血管障害)についてチェック項目を新しく設けるとともに、その他想定し得ない合併症も収集でき
るよう、自由記載欄も設けることといたしました。この旨、研究実施計画書 6.2.2 項を修正いたしました。さ
らに、研究分担者として新たに NICU を担当する小児科医師に加わって頂き、全身合併症に対して迅速
に対応できるよう、併診して頂く体制を整えました。
また、「想定外の有害事象が発生した場合の新規患者の登録中止ないしは登録中止の必要性や試
験実施計画改訂の必要性の検討の規定」に鑑み、具体的に個別の事例の独立データモニタリング委員
会への報告と共に、委員会の判断も含め 6 か月ごとにとりまとめを行い、研究組織内での共有を行うこ
とといたします。
4.(照会回答 5-1 に関連して)
①~③の対応については、試験実施計画書に記載する必要がある。③は中間解析のセクション
に追記することになるが、①、②は項を改めて規定することになるものと考える。
【回答】
ご指摘いただき、ありがとうございます。
①~③への対応および上記2.3への回答を踏まえて、試験実施計画書 17.4「安全性と不利益への
2
25
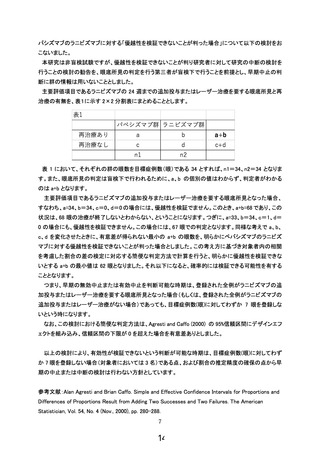
内での共有を行うことといたします。
3.(照会回答 5-1 に関連して)
「②想定外の有害事象が発生した場合の新規患者の登録中止ないしは登録中止の必要性や試
験実施計画改訂の必要性の検討の規定」の各群 3 例が登録された時点での検討を行うという対応
は良いが、眼科領域の事象に留まらない有害事象・副作用が発現した場合に適切に情報を収集し、
速やかに独立データモニタリング委員会、研究組織内で共有するために、予め有無を確認すべき事
象名を CRF に列記して情報を得る方式と、そこに列記されていない事象を個別に報告する方式とを
組み合わせて安全性情報を収集し、適宜リスクの評価を行うことが必要と考える。これに関連して、
安全性の確認のために、独立データモニタリング委員会の委員としてのみならず、各被験者の観察
に小児科の医師が(研究組織の一員として)関与することの必要性について検討されたい。また、研
究責任医師が問題と判断しない事象や発現頻度・グレードの違いが生じている事象についての第三
者的検討が可能になること等から、個別の報告に加え一定期間ごとに取りまとめを行い(例えば○ヶ
月毎、○例毎、など)、都度、独立データモニタリング委員会、研究組織内で共有することも検討され
たい(ただし、研究組織内の共有にあたっては一部の情報のマスキング等が必要になる可能性はあ
る)。
【回答】
ご指摘をいただきありがとうございます。眼科領域の事象に留まらない有害事象・副作用が発現した
場合に適切に情報を収集するため、CRF 内に全身性の重篤な合併症(呼吸不全、窒息、心筋梗塞、そ
の他心血管障害)についてチェック項目を新しく設けるとともに、その他想定し得ない合併症も収集でき
るよう、自由記載欄も設けることといたしました。この旨、研究実施計画書 6.2.2 項を修正いたしました。さ
らに、研究分担者として新たに NICU を担当する小児科医師に加わって頂き、全身合併症に対して迅速
に対応できるよう、併診して頂く体制を整えました。
また、「想定外の有害事象が発生した場合の新規患者の登録中止ないしは登録中止の必要性や試
験実施計画改訂の必要性の検討の規定」に鑑み、具体的に個別の事例の独立データモニタリング委員
会への報告と共に、委員会の判断も含め 6 か月ごとにとりまとめを行い、研究組織内での共有を行うこ
とといたします。
4.(照会回答 5-1 に関連して)
①~③の対応については、試験実施計画書に記載する必要がある。③は中間解析のセクション
に追記することになるが、①、②は項を改めて規定することになるものと考える。
【回答】
ご指摘いただき、ありがとうございます。
①~③への対応および上記2.3への回答を踏まえて、試験実施計画書 17.4「安全性と不利益への
2
25