よむ、つかう、まなぶ。
別紙2及び会議後指摘事項に対する回答 (35 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24171.html |
| 出典情報 | 先進医療会議 先進医療技術審査部会(第130回 3/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
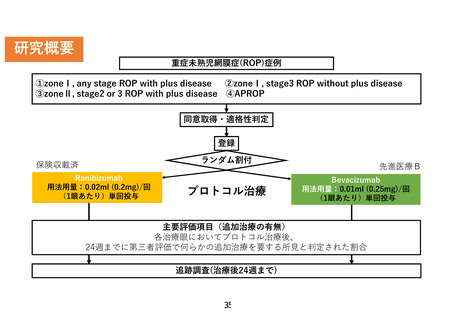
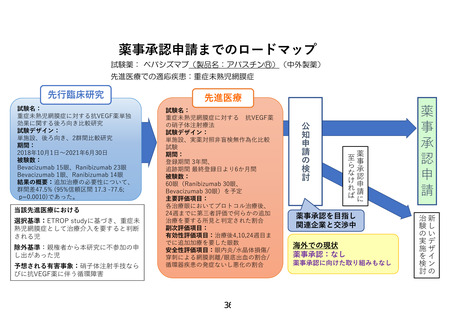
研究概要
重症未熟児網膜症(ROP)症例
①zoneⅠ, any stage ROP with plus disease
②zoneⅠ, stage3 ROP without plus disease
③zoneⅡ, stage2 or 3 ROP with plus disease ④APROP
同意取得・適格性判定
登録
ランダム割付
保険収載済
Ranibizumab
用法用量:0.02ml (0.2mg)/回
(1眼あたり)単回投与
プロトコル治療
先進医療B
Bevacizumab
用法用量:0.01ml (0.25mg)/回
(1眼あたり)単回投与
主要評価項目(追加治療の有無)
各治療眼においてプロトコル治療後、
24週までに第三者評価で何らかの追加治療を要する所見と判定された割合
追跡調査(治療後24週まで)
35
重症未熟児網膜症(ROP)症例
①zoneⅠ, any stage ROP with plus disease
②zoneⅠ, stage3 ROP without plus disease
③zoneⅡ, stage2 or 3 ROP with plus disease ④APROP
同意取得・適格性判定
登録
ランダム割付
保険収載済
Ranibizumab
用法用量:0.02ml (0.2mg)/回
(1眼あたり)単回投与
プロトコル治療
先進医療B
Bevacizumab
用法用量:0.01ml (0.25mg)/回
(1眼あたり)単回投与
主要評価項目(追加治療の有無)
各治療眼においてプロトコル治療後、
24週までに第三者評価で何らかの追加治療を要する所見と判定された割合
追跡調査(治療後24週まで)
35