よむ、つかう、まなぶ。
別紙2及び会議後指摘事項に対する回答 (36 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24171.html |
| 出典情報 | 先進医療会議 先進医療技術審査部会(第130回 3/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
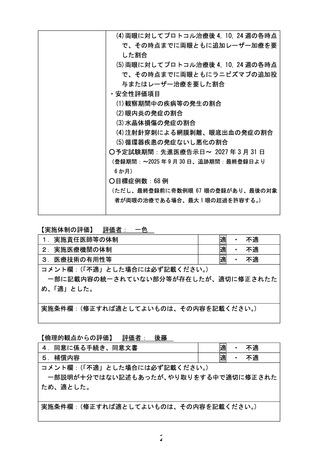
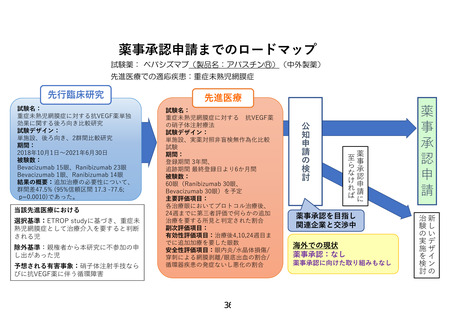
薬事承認申請までのロードマップ
試験薬: ベバシズマブ(製品名:アバスチン®)(中外製薬)
先進医療での適応疾患:重症未熟児網膜症
先行臨床研究
除外基準:親権者から本研究に不参加の申
し出があった児
予想される有害事象:硝子体注射手技なら
びに抗VEGF薬に伴う循環障害
36
薬事承認を目指し
関連企業と交渉中
海外での現状
薬事承認:なし
薬事承認に向けた取り組みもなし
薬
事
承
認
申
請
新しいデザインの
治験の実施を検討
選択基準:ETROP studyに基づき、重症未
熟児網膜症として治療介入を要すると判断
される児
薬事承認申請に
至らなければ
当該先進医療における
試験名:
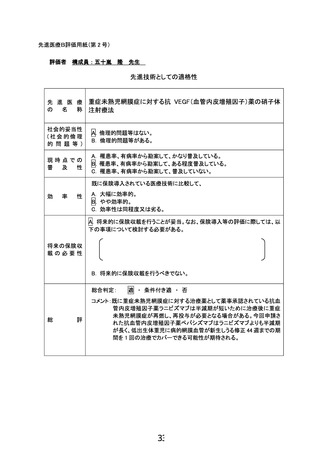
重症未熟児網膜症に対する 抗VEGF薬
の硝子体注射療法
試験デザイン:
単施設、実薬対照非盲検無作為化比較
試験
期間:
登録期間 3年間、
追跡期間 最終登録日より6か月間
被験数:
60眼(Ranibizumab 30眼、
Bevacizumab 30眼)を予定
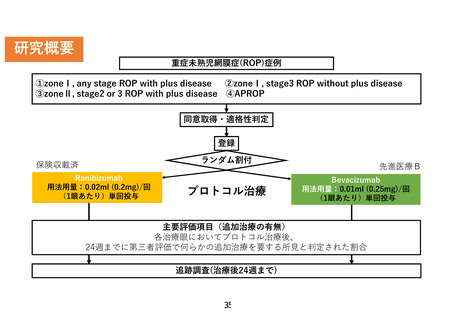
主要評価項目:
各治療眼においてプロトコル治療後、
24週までに第三者評価で何らかの追加
治療を要する所見と判定された割合
副次評価項目:
有効性評価項目:治療後4,10,24週目ま
でに追加加療を要した眼数
安全性評価項目:眼内炎/水晶体損傷/
穿刺による網膜剥離/眼底出血の割合/
循環器疾患の発症ないし悪化の割合
公知申請の 検討
試験名:
重症未熟児網膜症に対する抗VEGF薬単独
効果に関する後ろ向き比較研究
試験デザイン:
単施設、後ろ向き、2群間比較研究
期間:
2018年10月1日~2021年6月30日
被験数:
Bevacizumab 15眼、Ranibizumab 23眼
Bevacizumab 1眼、Ranibizumab 14眼
結果の概要:追加治療の必要性について、
群間差47.5% (95%信頼区間 17.3 -77.6;
p=0.0010)であった。
先進医療
試験薬: ベバシズマブ(製品名:アバスチン®)(中外製薬)
先進医療での適応疾患:重症未熟児網膜症
先行臨床研究
除外基準:親権者から本研究に不参加の申
し出があった児
予想される有害事象:硝子体注射手技なら
びに抗VEGF薬に伴う循環障害
36
薬事承認を目指し
関連企業と交渉中
海外での現状
薬事承認:なし
薬事承認に向けた取り組みもなし
薬
事
承
認
申
請
新しいデザインの
治験の実施を検討
選択基準:ETROP studyに基づき、重症未
熟児網膜症として治療介入を要すると判断
される児
薬事承認申請に
至らなければ
当該先進医療における
試験名:
重症未熟児網膜症に対する 抗VEGF薬
の硝子体注射療法
試験デザイン:
単施設、実薬対照非盲検無作為化比較
試験
期間:
登録期間 3年間、
追跡期間 最終登録日より6か月間
被験数:
60眼(Ranibizumab 30眼、
Bevacizumab 30眼)を予定
主要評価項目:
各治療眼においてプロトコル治療後、
24週までに第三者評価で何らかの追加
治療を要する所見と判定された割合
副次評価項目:
有効性評価項目:治療後4,10,24週目ま
でに追加加療を要した眼数
安全性評価項目:眼内炎/水晶体損傷/
穿刺による網膜剥離/眼底出血の割合/
循環器疾患の発症ないし悪化の割合
公知申請の 検討
試験名:
重症未熟児網膜症に対する抗VEGF薬単独
効果に関する後ろ向き比較研究
試験デザイン:
単施設、後ろ向き、2群間比較研究
期間:
2018年10月1日~2021年6月30日
被験数:
Bevacizumab 15眼、Ranibizumab 23眼
Bevacizumab 1眼、Ranibizumab 14眼
結果の概要:追加治療の必要性について、
群間差47.5% (95%信頼区間 17.3 -77.6;
p=0.0010)であった。
先進医療