よむ、つかう、まなぶ。
○最適使用推進ガイドラインについて 総ー3-1 (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00231.html |
| 出典情報 | 中央社会保険医療協議会 総会(第572回 12/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
4.投与対象となる患者及び投与施設
本剤は「1.はじめに」でも記載したように、認知症に対する新規作用機序の医薬品であり、
臨床試験における有効性及び安全性を踏まえ、適切な患者選択や投与判断、重篤な副作用
発現の際の迅速な安全対策等を確保した上で、最適な薬物療法を提供できるように進めてい
く必要があることから、本項で規定する患者・施設において使用すべきである。
なお、本ガイドラインで定める要件は、臨床試験の情報等を踏まえ、製造販売を開始された
段階で適当と考えられる規定であり、今後の本剤に係る有効性・安全性の情報の集積等の状
況を踏まえ、必要に応じて今後見直しを行うこととする。
(1)投与対象となる患者
投与の要否の判断にあたっては、以下のすべてに該当するアルツハイマー病による軽
度認知障害及び軽度の認知症の患者であることを確認する。無症候で Aβ 病理を示唆す
る所見のみが確認できた者及び中等度以降のアルツハイマー病による認知症患者には投
与開始しないこと。
① 患者本人及び家族・介護者の、安全性に関する内容も踏まえ本剤による治療意思
が確認されていること。
② 本剤の禁忌に該当しないこと。
【禁忌】
本剤の成分に対し重篤な過敏症の既往歴がある患者。
本剤投与開始前に血管原性脳浮腫、5 個以上の脳微小出血、脳表ヘモジデリ
ン沈着症又は 1 cm を超える脳出血が認められる患者。
③ MRI 検査(1.5 Tesla 以上)が実施可能であること。(例:金属を含む医療機器(MR 装
置に対する適合性が確認された製品を除く)を植込み又は留置した患者は不可)
④ 認知機能の低下及び臨床症状の重症度範囲が以下の(a)及び(b)の両方を満たす
ことが、投与開始前 1 か月以内の期間を目安に確認されていること。
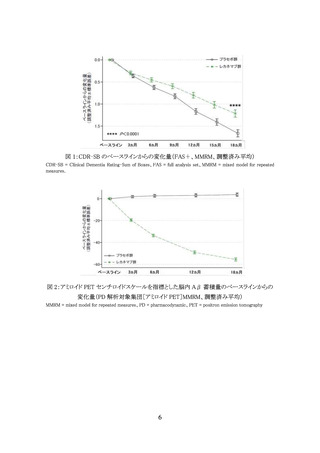
(a) 認知機能評価 MMSE スコア 22 点以上
(b) 臨床認知症尺度 CDR 全般スコア 0.5 又は 1
独居者の場合は、患者の周囲の者、地域包括支援センター、医療ソーシャル
ワーカー等の協力を得て、独居者の日常生活の様子を聴取することにより客観
的な評価を行い、CDR 全般スコアを評価すること。
ただし、患者の周囲の者、地域包括支援センター、医療ソーシャルワーカー等
からの情報が得られない等、CDR 全般スコア評価が困難な場合は、他の評価方
法により、、認知症の重症度の範囲が同等であることを確認した上で用いること。
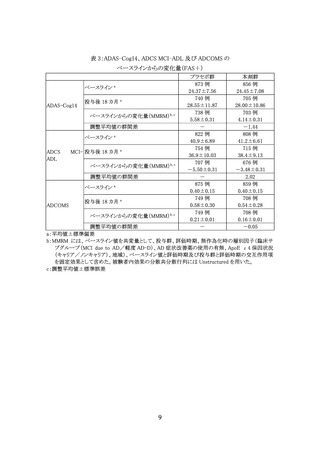
⑤ ①~④を満たすことを確認した上で、アミロイド PET 又は脳脊髄液(CSF)検査を実
施し、Aβ 病理を示唆する所見が確認されていること。
11
本剤は「1.はじめに」でも記載したように、認知症に対する新規作用機序の医薬品であり、
臨床試験における有効性及び安全性を踏まえ、適切な患者選択や投与判断、重篤な副作用
発現の際の迅速な安全対策等を確保した上で、最適な薬物療法を提供できるように進めてい
く必要があることから、本項で規定する患者・施設において使用すべきである。
なお、本ガイドラインで定める要件は、臨床試験の情報等を踏まえ、製造販売を開始された
段階で適当と考えられる規定であり、今後の本剤に係る有効性・安全性の情報の集積等の状
況を踏まえ、必要に応じて今後見直しを行うこととする。
(1)投与対象となる患者
投与の要否の判断にあたっては、以下のすべてに該当するアルツハイマー病による軽
度認知障害及び軽度の認知症の患者であることを確認する。無症候で Aβ 病理を示唆す
る所見のみが確認できた者及び中等度以降のアルツハイマー病による認知症患者には投
与開始しないこと。
① 患者本人及び家族・介護者の、安全性に関する内容も踏まえ本剤による治療意思
が確認されていること。
② 本剤の禁忌に該当しないこと。
【禁忌】
本剤の成分に対し重篤な過敏症の既往歴がある患者。
本剤投与開始前に血管原性脳浮腫、5 個以上の脳微小出血、脳表ヘモジデリ
ン沈着症又は 1 cm を超える脳出血が認められる患者。
③ MRI 検査(1.5 Tesla 以上)が実施可能であること。(例:金属を含む医療機器(MR 装
置に対する適合性が確認された製品を除く)を植込み又は留置した患者は不可)
④ 認知機能の低下及び臨床症状の重症度範囲が以下の(a)及び(b)の両方を満たす
ことが、投与開始前 1 か月以内の期間を目安に確認されていること。
(a) 認知機能評価 MMSE スコア 22 点以上
(b) 臨床認知症尺度 CDR 全般スコア 0.5 又は 1
独居者の場合は、患者の周囲の者、地域包括支援センター、医療ソーシャル
ワーカー等の協力を得て、独居者の日常生活の様子を聴取することにより客観
的な評価を行い、CDR 全般スコアを評価すること。
ただし、患者の周囲の者、地域包括支援センター、医療ソーシャルワーカー等
からの情報が得られない等、CDR 全般スコア評価が困難な場合は、他の評価方
法により、、認知症の重症度の範囲が同等であることを確認した上で用いること。
⑤ ①~④を満たすことを確認した上で、アミロイド PET 又は脳脊髄液(CSF)検査を実
施し、Aβ 病理を示唆する所見が確認されていること。
11