よむ、つかう、まなぶ。
○最適使用推進ガイドラインについて 総ー3-1 (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00231.html |
| 出典情報 | 中央社会保険医療協議会 総会(第572回 12/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
3.臨床成績
製造販売承認時に評価を行った主な臨床試験の成績を示す。
国際共同第Ⅲ相試験(BAN2401-G000-301 試験)
【試験の概要】
本剤の早期 AD の病態進行抑制作用を検証する目的で、早期 AD 患者 1795 例(うち日本
人 152 例)を対象とした無作為化二重盲検並行群間比較試験が国内外 235 施設で実施され
た。
無作為化後の 18 カ月間が Core Study とされ、Core Study 後の最大 48 カ月間が非盲検継
続投与期とされた。用法・用量は、Core Study ではプラセボ又は本剤 10 mg/kg を 2 週間に 1
回静脈内投与、非盲検継続投与期では本剤 10 mg/kg を 2 週間に 1 回静脈内投与とされた。
なお、非盲検継続投与期の有効性に関する解析は、データカットオフ時点で評価可能な被験
者数が限られていたことから、実施されていない。
[主な選択基準]
NIA-AA 基準による MCI due to AD 又は AD-D の中核となる臨床基準を満たし、かつ以下
を満たす 50~90 歳の早期 AD 患者
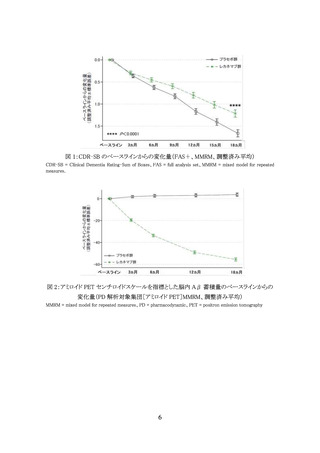
Clinical Dementia Rating(CDR)スコアが 0.5~1
CDR の記憶スコアが 0.5 以上
WMS-Ⅳ LM Ⅱの点数が年齢調整平均値を少なくとも 1 標準偏差下回る(50~64 歳:15
以下、65~69 歳:12 以下、70~74 歳:11 以下、75~79 歳:9 以下、80~90 歳:7 以下)
エピソード記憶障害が客観的に示される
Mini Mental State Examination(MMSE)スコアが 22~30
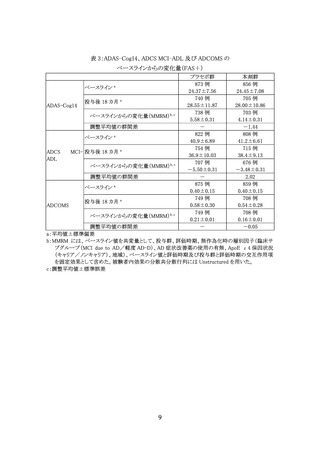
アミロイド PET 検査による脳内への PET 薬剤の取込み又は CSF 中 t-tau/Aβ(1-42)比
のいずれかの評価によりアミロイド陽性を示唆する所見が確認されている
Geriatric depression scale(GDS)スコアが 8 未満
脳 MRI 検査において、以下に示すような臨床的意義のある所見が認められていない
➢ 5 カ所以上の脳微小出血(最大径 10 mm 以下)
➢ 最大径 10 mm 超の脳出血
➢ 脳表ヘモジデリン沈着症
➢ 血管原性脳浮腫
➢ 脳挫傷、脳軟化、動脈瘤、血管奇形又は感染病巣
➢ 多発性ラクナ梗塞、大血管支配領域の脳卒中、重度の小血管疾患又は白質疾患
➢ 占拠性病変又は脳腫瘍(ただし、髄膜腫又はくも膜嚢胞と診断される病変で、最大径が
1 cm 未満であれば除外する必要はない)
4
製造販売承認時に評価を行った主な臨床試験の成績を示す。
国際共同第Ⅲ相試験(BAN2401-G000-301 試験)
【試験の概要】
本剤の早期 AD の病態進行抑制作用を検証する目的で、早期 AD 患者 1795 例(うち日本
人 152 例)を対象とした無作為化二重盲検並行群間比較試験が国内外 235 施設で実施され
た。
無作為化後の 18 カ月間が Core Study とされ、Core Study 後の最大 48 カ月間が非盲検継
続投与期とされた。用法・用量は、Core Study ではプラセボ又は本剤 10 mg/kg を 2 週間に 1
回静脈内投与、非盲検継続投与期では本剤 10 mg/kg を 2 週間に 1 回静脈内投与とされた。
なお、非盲検継続投与期の有効性に関する解析は、データカットオフ時点で評価可能な被験
者数が限られていたことから、実施されていない。
[主な選択基準]
NIA-AA 基準による MCI due to AD 又は AD-D の中核となる臨床基準を満たし、かつ以下
を満たす 50~90 歳の早期 AD 患者
Clinical Dementia Rating(CDR)スコアが 0.5~1
CDR の記憶スコアが 0.5 以上
WMS-Ⅳ LM Ⅱの点数が年齢調整平均値を少なくとも 1 標準偏差下回る(50~64 歳:15
以下、65~69 歳:12 以下、70~74 歳:11 以下、75~79 歳:9 以下、80~90 歳:7 以下)
エピソード記憶障害が客観的に示される
Mini Mental State Examination(MMSE)スコアが 22~30
アミロイド PET 検査による脳内への PET 薬剤の取込み又は CSF 中 t-tau/Aβ(1-42)比
のいずれかの評価によりアミロイド陽性を示唆する所見が確認されている
Geriatric depression scale(GDS)スコアが 8 未満
脳 MRI 検査において、以下に示すような臨床的意義のある所見が認められていない
➢ 5 カ所以上の脳微小出血(最大径 10 mm 以下)
➢ 最大径 10 mm 超の脳出血
➢ 脳表ヘモジデリン沈着症
➢ 血管原性脳浮腫
➢ 脳挫傷、脳軟化、動脈瘤、血管奇形又は感染病巣
➢ 多発性ラクナ梗塞、大血管支配領域の脳卒中、重度の小血管疾患又は白質疾患
➢ 占拠性病変又は脳腫瘍(ただし、髄膜腫又はくも膜嚢胞と診断される病変で、最大径が
1 cm 未満であれば除外する必要はない)
4