よむ、つかう、まなぶ。
○最適使用推進ガイドラインについて 総ー3-1 (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00231.html |
| 出典情報 | 中央社会保険医療協議会 総会(第572回 12/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(3)投与期間中の対応
① 投与期間中の有効性及び安全性の評価、投与継続・中止の判断
本剤投与期間中は、初回投与施設において定期的に以下の有効性及び安全性の
評価に係る対応を行うこと。
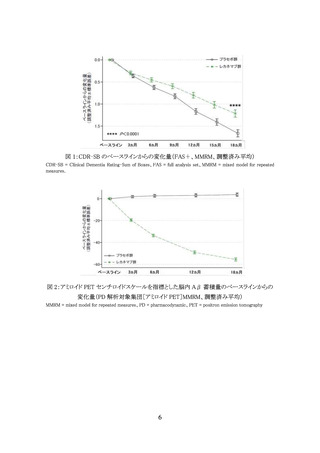
ア 本剤投与開始後、6 か月に 1 回、CDR 全般スコア推移、MMSE スコア推移、患者
及び家族・介護者から自他覚症状の聴取等による臨床症状の評価を行い、臨床
症状の経過から本剤の有効性が期待できないと考えられる場合は本剤の投与を
中止すること。
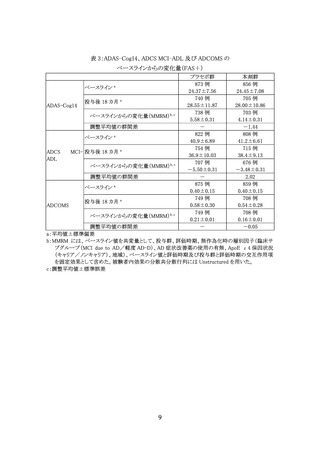
イ 本剤投与開始後は、本剤の 5 回目の投与前(投与開始後 2 か月までを目安)、7
回目の投与前(投与開始後3か月までを目安)、14 回目の投与前(投与開始後 6
か月までを目安)、以降 6 か月に 1 回、MRI 検査を実施し、ARIA 発現の有無を
確認すること。また、ARIA を示唆する症状が認められた場合には、臨床評価を行
い、必要に応じて MRI 検査を実施すること。ARIA が認められた場合には、添付
文書の注意喚起に基づいて、本剤の投与中止又は投与継続の可否を判断する
こと。
本剤の投与は原則 18 か月までとするが、18 か月以上継続する場合は、以下の有効
性及び安全性の評価に係る対応を行うこと。
ア 上記に掲げるアの臨床症状の評価及びイの評価を行った上で、18 か月時点で
の臨床的進行・病期に関する診断、投薬の効果、CDR 全般スコア及び MMSE の
認知症スコアを踏まえた認知機能の評価、日常生活機能の評価、有害事象の発
現状況等から、本剤投与の継続の要否を判断すること。
イ 中等度以降のアルツハイマー病による認知症と診断された場合、中等度以降に
進行した患者に投与を継続したときの有効性が確立していないことから、本剤の
投与を中止し、再評価を行うこと。なお、再評価に当たっては、「4.投与対象とな
る患者及び投与施設」の「(1)投与対象となる患者」で規定している評価①~④を
確認した上で、投与の必要性を判断すること。
16
① 投与期間中の有効性及び安全性の評価、投与継続・中止の判断
本剤投与期間中は、初回投与施設において定期的に以下の有効性及び安全性の
評価に係る対応を行うこと。
ア 本剤投与開始後、6 か月に 1 回、CDR 全般スコア推移、MMSE スコア推移、患者
及び家族・介護者から自他覚症状の聴取等による臨床症状の評価を行い、臨床
症状の経過から本剤の有効性が期待できないと考えられる場合は本剤の投与を
中止すること。
イ 本剤投与開始後は、本剤の 5 回目の投与前(投与開始後 2 か月までを目安)、7
回目の投与前(投与開始後3か月までを目安)、14 回目の投与前(投与開始後 6
か月までを目安)、以降 6 か月に 1 回、MRI 検査を実施し、ARIA 発現の有無を
確認すること。また、ARIA を示唆する症状が認められた場合には、臨床評価を行
い、必要に応じて MRI 検査を実施すること。ARIA が認められた場合には、添付
文書の注意喚起に基づいて、本剤の投与中止又は投与継続の可否を判断する
こと。
本剤の投与は原則 18 か月までとするが、18 か月以上継続する場合は、以下の有効
性及び安全性の評価に係る対応を行うこと。
ア 上記に掲げるアの臨床症状の評価及びイの評価を行った上で、18 か月時点で
の臨床的進行・病期に関する診断、投薬の効果、CDR 全般スコア及び MMSE の
認知症スコアを踏まえた認知機能の評価、日常生活機能の評価、有害事象の発
現状況等から、本剤投与の継続の要否を判断すること。
イ 中等度以降のアルツハイマー病による認知症と診断された場合、中等度以降に
進行した患者に投与を継続したときの有効性が確立していないことから、本剤の
投与を中止し、再評価を行うこと。なお、再評価に当たっては、「4.投与対象とな
る患者及び投与施設」の「(1)投与対象となる患者」で規定している評価①~④を
確認した上で、投与の必要性を判断すること。
16