よむ、つかう、まなぶ。
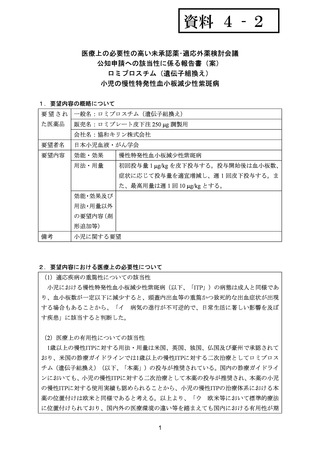
資料4-2 ロミプロスチム(遺伝子組換え) (14 ページ)
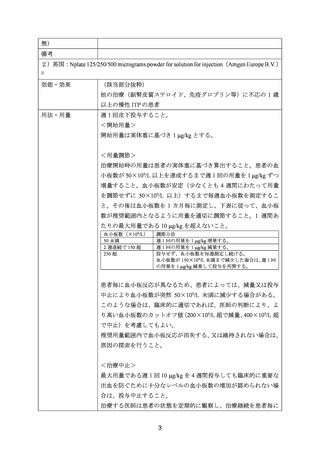
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00032.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第58回 3/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
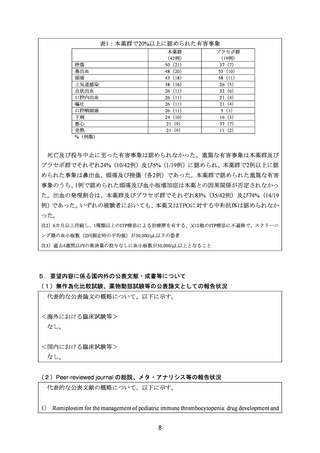
表 6:本薬の国内副作用報告の内訳
副作用名[MedDRA PT(ver.26.0)
]
巨核球異常
血小板数増加
好中球数減少
頭痛
鼻出血
悪心
下部消化管出血
下痢
芽球細胞
肝障害
巨核球増加
胸痛
血小板障害
血小板数減少
骨髄生検異常
自己免疫性溶血性貧血
上部消化管出血
腎機能障害
全血球数異常
脱毛症
注射部位紅斑
注射部位腫脹
鉄欠乏性貧血
脳出血
白血球数減少
白血球数増加
発熱
蕁麻疹
件数
2
2
2
2
2
1
1
1
1
1
1
1
1
1
1
1
1
1
1
1
1
1
1
1
1
1
1
1
未知の副作用は 15 件認められ、このうち 2 件以上発生した副作用は巨核球異常 2 件、好
中球数減少 2 件であった。しかしながら、いずれの副作用も小児集団において特異的に発
現した副作用ではなく、原疾患がリスク因子であり一定割合の ITP 患者でこれらの合併症
を有すると考えられることから、追加の注意喚起は不要と判断した。
また、海外の副作用報告においても、3 件以上発現した副作用は国内添付文書で注意喚起
されている事象であり、既知の安全性プロファイルと同様であった。
以上より、検討会議は以下のように判断する。
小児の ITP に対して本薬が承認されている海外において、小児の ITP 特有のリスクは報
告されていない。また、国内で本薬を小児の ITP 患者に投与した際に 2 件以上報告された
未知の副作用である巨核球異常及び好中球数減少は、原疾患の病態及び本薬の作用機序か
ら想定される事象であった。したがって、成人の慢性 ITP における本薬の安全性に問題と
なるような国内外差は認められていないことも踏まえると、成人と同様のモニタリングや
用量調節がなされるのであれば、日本人の小児の慢性 ITP 患者における本薬投与時の安全
性は管理可能である。
14
67 / 213
副作用名[MedDRA PT(ver.26.0)
]
巨核球異常
血小板数増加
好中球数減少
頭痛
鼻出血
悪心
下部消化管出血
下痢
芽球細胞
肝障害
巨核球増加
胸痛
血小板障害
血小板数減少
骨髄生検異常
自己免疫性溶血性貧血
上部消化管出血
腎機能障害
全血球数異常
脱毛症
注射部位紅斑
注射部位腫脹
鉄欠乏性貧血
脳出血
白血球数減少
白血球数増加
発熱
蕁麻疹
件数
2
2
2
2
2
1
1
1
1
1
1
1
1
1
1
1
1
1
1
1
1
1
1
1
1
1
1
1
未知の副作用は 15 件認められ、このうち 2 件以上発生した副作用は巨核球異常 2 件、好
中球数減少 2 件であった。しかしながら、いずれの副作用も小児集団において特異的に発
現した副作用ではなく、原疾患がリスク因子であり一定割合の ITP 患者でこれらの合併症
を有すると考えられることから、追加の注意喚起は不要と判断した。
また、海外の副作用報告においても、3 件以上発現した副作用は国内添付文書で注意喚起
されている事象であり、既知の安全性プロファイルと同様であった。
以上より、検討会議は以下のように判断する。
小児の ITP に対して本薬が承認されている海外において、小児の ITP 特有のリスクは報
告されていない。また、国内で本薬を小児の ITP 患者に投与した際に 2 件以上報告された
未知の副作用である巨核球異常及び好中球数減少は、原疾患の病態及び本薬の作用機序か
ら想定される事象であった。したがって、成人の慢性 ITP における本薬の安全性に問題と
なるような国内外差は認められていないことも踏まえると、成人と同様のモニタリングや
用量調節がなされるのであれば、日本人の小児の慢性 ITP 患者における本薬投与時の安全
性は管理可能である。
14
67 / 213