よむ、つかう、まなぶ。
資料4-2 ロミプロスチム(遺伝子組換え) (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00032.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第58回 3/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
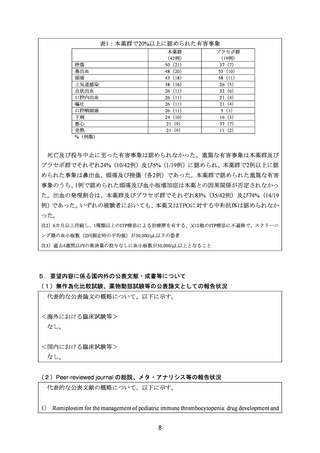
表1:本薬群で20%以上に認められた有害事象
本薬群
(42例)
50(21)
48(20)
43(18)
38(16)
26(11)
26(11)
26(11)
26(11)
24(10)
21(9)
21(9)
挫傷
鼻出血
頭痛
上気道感染
点状出血
口腔内出血
嘔吐
口腔咽頭痛
下痢
悪心
発熱
%(例数)
プラセボ群
(19例)
37(7)
53(10)
58(11)
26(5)
32(6)
21(4)
21(4)
5(1)
16(3)
37(7)
11(2)
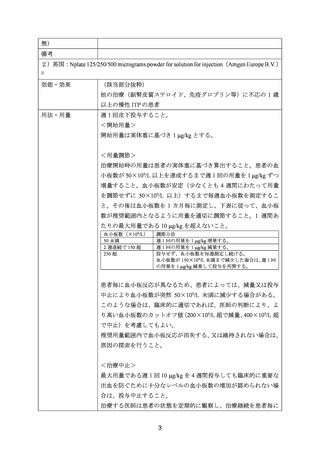
死亡及び投与中止に至った有害事象は認められなかった。重篤な有害事象は本薬群及び
プラセボ群でそれぞれ24%(10/42例)及び5%(1/19例)に認められ、本薬群で2例以上に認
められた事象は鼻出血、頭痛及び挫傷(各2例)であった。本薬群で認められた重篤な有害
事象のうち、1例で認められた頭痛及び血小板増加症は本薬との因果関係が否定されなかっ
た。出血の発現割合は、本薬群及びプラセボ群でそれぞれ83%(35/42例)及び74%(14/19
例)であった。いずれの被験者においても、本薬又はTPOに対する中和抗体は認められなか
った。
注2)6カ月以上持続し、1種類以上のITP療法による治療歴を有する、又は他のITP療法に不適格で、スクリーニ
ング期の血小板数(2回測定時の平均値)が30,000/μL以下の患者
注3)過去4週間以内の救済薬の投与なしに血小板数が50,000/μL以上となること
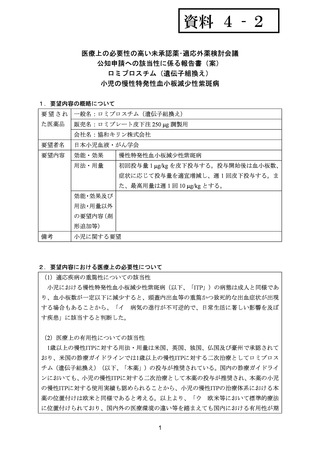
5.要望内容に係る国内外の公表文献・成書等について
(1)無作為化比較試験、薬物動態試験等の公表論文としての報告状況
代表的な公表論文の概略について、以下に示す。
<海外における臨床試験等>
なし。
<国内における臨床試験等>
なし。
(2)Peer-reviewed journal の総説、メタ・アナリシス等の報告状況
代表的な公表文献の概略について、以下に示す。
1) Romiplostim for the management of pediatric immune thrombocytopenia: drug development and
8
61 / 213
本薬群
(42例)
50(21)
48(20)
43(18)
38(16)
26(11)
26(11)
26(11)
26(11)
24(10)
21(9)
21(9)
挫傷
鼻出血
頭痛
上気道感染
点状出血
口腔内出血
嘔吐
口腔咽頭痛
下痢
悪心
発熱
%(例数)
プラセボ群
(19例)
37(7)
53(10)
58(11)
26(5)
32(6)
21(4)
21(4)
5(1)
16(3)
37(7)
11(2)
死亡及び投与中止に至った有害事象は認められなかった。重篤な有害事象は本薬群及び
プラセボ群でそれぞれ24%(10/42例)及び5%(1/19例)に認められ、本薬群で2例以上に認
められた事象は鼻出血、頭痛及び挫傷(各2例)であった。本薬群で認められた重篤な有害
事象のうち、1例で認められた頭痛及び血小板増加症は本薬との因果関係が否定されなかっ
た。出血の発現割合は、本薬群及びプラセボ群でそれぞれ83%(35/42例)及び74%(14/19
例)であった。いずれの被験者においても、本薬又はTPOに対する中和抗体は認められなか
った。
注2)6カ月以上持続し、1種類以上のITP療法による治療歴を有する、又は他のITP療法に不適格で、スクリーニ
ング期の血小板数(2回測定時の平均値)が30,000/μL以下の患者
注3)過去4週間以内の救済薬の投与なしに血小板数が50,000/μL以上となること
5.要望内容に係る国内外の公表文献・成書等について
(1)無作為化比較試験、薬物動態試験等の公表論文としての報告状況
代表的な公表論文の概略について、以下に示す。
<海外における臨床試験等>
なし。
<国内における臨床試験等>
なし。
(2)Peer-reviewed journal の総説、メタ・アナリシス等の報告状況
代表的な公表文献の概略について、以下に示す。
1) Romiplostim for the management of pediatric immune thrombocytopenia: drug development and
8
61 / 213