よむ、つかう、まなぶ。
最終とりまとめ(概要版) (16 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41063.html |
| 出典情報 | ヘルスケアスタートアップ等の振興・支援策検討プロジェクトチーム 最終とりまとめの公表について(6/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
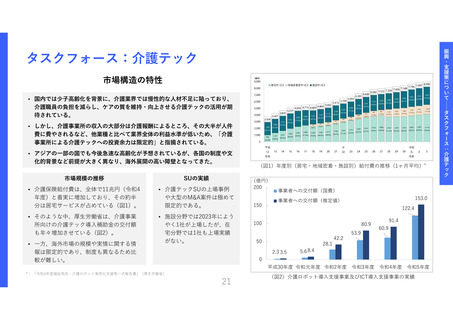
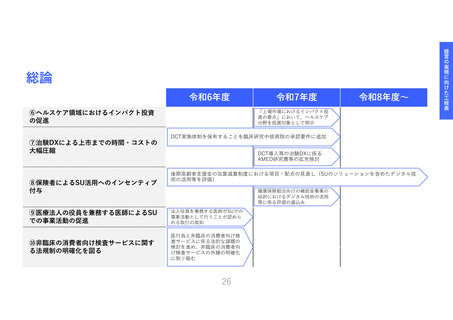
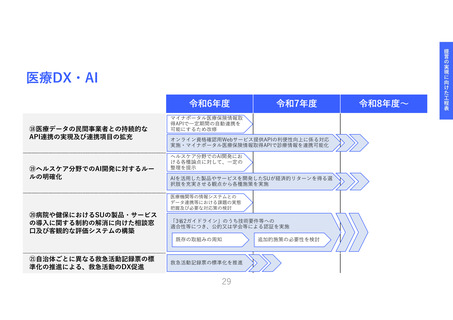
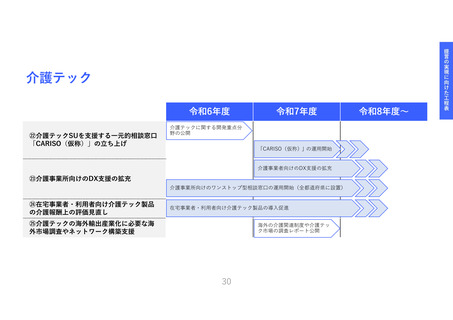
医療機器SUへの資金支援と臨床研究中核
病院等への支援を拡充し、命に近い革新
的な治療用医療機器等*の臨床エビデンス
獲得を促進する
• 令和7年度より、革新的な治療用医療機器のFIH試験等に協力する臨床研究中
核病院等に対する補助金を拡充する。
• 令和7年度以降、ニーズ探索・特定やコンセプト検証、医師・医療機関へのア
クセス機会の提供に加え、医師・関連学会との連携も視野に入れた拠点事業を
更に充実・強化する。
• CIN**の取組み強化等によるレジストリ整備を通じ、次世代の医療機器開発に
向けたデータ利活用を促進する。
*:医療機器のクラス分類におけるクラスIII・IV相当
**:クリニカル・イノベーション・ネットワーク
革新的な治療用医療機器等による米国を
はじめとする世界市場の獲得を目指し、
医療機器SUへの海外展開支援を拡充する
• 令和7年度より、米国市場獲得に向け、JETRO等の組織と連携し、海外展開戦
略の構築や臨床試験等への支援強化や、大手企業や現地の医療機関等と医療機
器SUの連携強化を図る。
• アジア等の新興国に対する薬事規制の国際協調を戦略的に推進し、当該国の
ニーズを踏まえた製品開発やキーパーソンとのコミュニティ形成を支援する。
• 令和7年度に調査を実施し、令和8年度より医療機器分野における薬事規制の国
際標準化の取り組みを推進する。
SaMDの開発・事業化の制約となりうる
業許可規制及び広告規制等を緩和する
• 令和7年度より、事業開発の促進と製品の質担保を両立する形で、医療機器製
造販売業の取得要件を緩和する。
• 令和7年度にワーキンググループを立ち上げ、家庭用SaMD製品の広告に関し、
承認申請時添付データ等の客観性の担保された臨床データの利用を可能とする
ことを検討する。
16
病院等への支援を拡充し、命に近い革新
的な治療用医療機器等*の臨床エビデンス
獲得を促進する
• 令和7年度より、革新的な治療用医療機器のFIH試験等に協力する臨床研究中
核病院等に対する補助金を拡充する。
• 令和7年度以降、ニーズ探索・特定やコンセプト検証、医師・医療機関へのア
クセス機会の提供に加え、医師・関連学会との連携も視野に入れた拠点事業を
更に充実・強化する。
• CIN**の取組み強化等によるレジストリ整備を通じ、次世代の医療機器開発に
向けたデータ利活用を促進する。
*:医療機器のクラス分類におけるクラスIII・IV相当
**:クリニカル・イノベーション・ネットワーク
革新的な治療用医療機器等による米国を
はじめとする世界市場の獲得を目指し、
医療機器SUへの海外展開支援を拡充する
• 令和7年度より、米国市場獲得に向け、JETRO等の組織と連携し、海外展開戦
略の構築や臨床試験等への支援強化や、大手企業や現地の医療機関等と医療機
器SUの連携強化を図る。
• アジア等の新興国に対する薬事規制の国際協調を戦略的に推進し、当該国の
ニーズを踏まえた製品開発やキーパーソンとのコミュニティ形成を支援する。
• 令和7年度に調査を実施し、令和8年度より医療機器分野における薬事規制の国
際標準化の取り組みを推進する。
SaMDの開発・事業化の制約となりうる
業許可規制及び広告規制等を緩和する
• 令和7年度より、事業開発の促進と製品の質担保を両立する形で、医療機器製
造販売業の取得要件を緩和する。
• 令和7年度にワーキンググループを立ち上げ、家庭用SaMD製品の広告に関し、
承認申請時添付データ等の客観性の担保された臨床データの利用を可能とする
ことを検討する。
16