よむ、つかう、まなぶ。
資料2-2 ベポタスチンベシル酸塩のリスク区分について[5.2MB] (29 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42464.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会安全対策調査会(令和6年度第5回 8/28)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
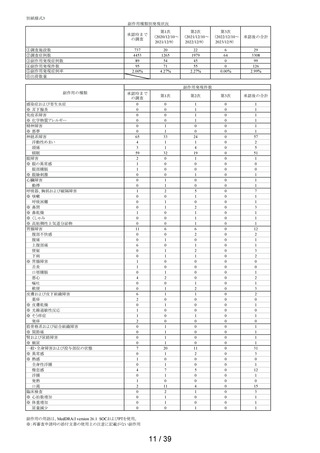
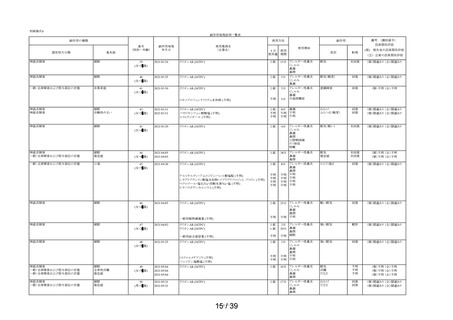
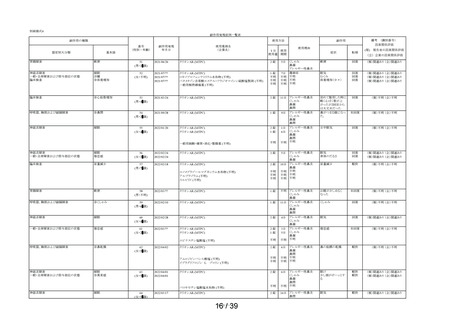
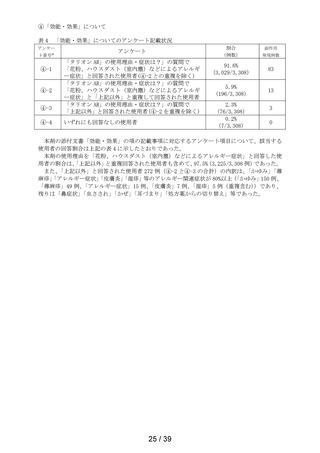
1.3 集計表(アンケート別副作用件数入り
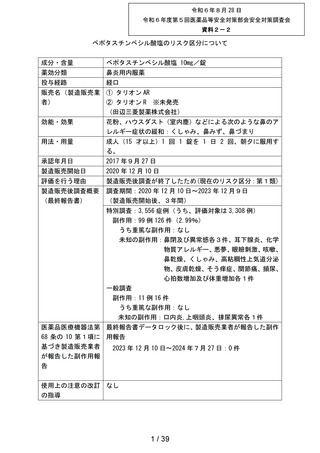
してはいけないこと
副作用発現件数
副作用の種類
感染症および寄生虫症
※ 耳下腺炎
免疫系障害
※ 化学物質アレルギー
精神障害
※ 悪夢
神経系障害
浮動性めまい
頭痛
傾眠
眼障害
※ 眼の異常感
眼部腫脹
※ 眼瞼刺激
心臓障害
動悸
呼吸器、胸郭および縦隔障害
※ 咳嗽
呼吸困難
※ 鼻閉
※ 鼻乾燥
※ くしゃみ
※ 高粘稠性上気道分泌物
胃腸障害
腹部不快感
腹痛
上腹部痛
便秘
下痢
※ 胃腸障害
舌炎
口唇腫脹
悪心
嘔吐
軟便
皮膚および皮下組織障害
薬疹
※ 皮膚乾燥
※ 光線過敏性反応
※ そう痒症
発疹
筋骨格系および結合組織障害
※ 関節痛
腎および尿路障害
※ 頻尿
一般・全身障害および投与部位の状態
※ 異常感
※ 熱感
全身性浮腫
倦怠感
浮腫
発熱
口渇
臨床検査
※ 心拍数増加
※ 体重増加
尿量減少
承認時ま
で
の調査
0
0
0
0
0
0
65
4
3
59
2
1
1
0
0
0
1
0
0
0
1
0
0
11
0
0
6
0
0
1
1
0
4
0
0
6
2
0
1
1
2
0
0
0
0
7
0
1
0
4
0
1
2
0
0
0
0
第1次
第2次
第3次
0
0
0
0
1
1
33
1
1
32
0
0
0
0
1
1
2
0
1
1
0
0
0
6
0
1
0
1
1
0
0
1
2
0
1
1
0
1
0
0
0
1
1
1
1
20
1
0
1
7
1
0
11
2
1
1
0
1
1
1
1
0
0
24
1
4
19
1
0
0
1
0
0
5
1
0
2
1
1
1
6
2
0
1
2
1
0
0
0
0
1
2
1
0
0
0
1
0
0
0
0
0
11
2
0
0
5
0
0
4
1
0
0
1
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
承認後の
①-1
合計
1
1
1
1
1
1
57
2
5
51
1
0
0
1
1
1
7
1
1
3
1
1
1
12
2
1
1
3
2
0
0
1
2
1
3
2
0
1
0
1
0
1
1
1
1
31
3
0
1
12
1
0
15
3
1
1
1
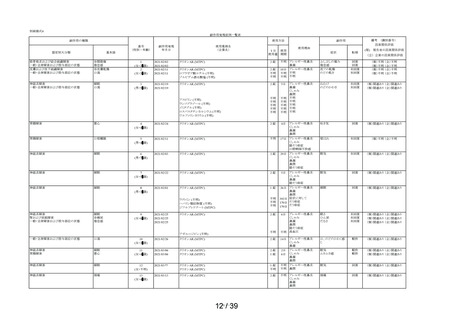
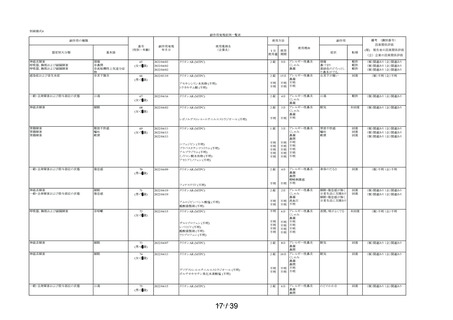
①-2
①-3
①-4
相談すること
①-5
②-1
②-2
②-3
1
1
1
2
1
2
17
1
3
14
用法・用量
②-4
1
1
3
4
3
4
②-5
1
1
17
1
1
16
③-1
1
1
1
1
1
1
45
1
4
41
③-2
効能・効果
③-3
1
1
1
1
1
1
1
4
4
1
8
1
1
6
1
1
4
1
1
1
3
2
1
1
1
1
1
1
2
1
1
1
1
3
1
2
1
1
1
1
1
1
1
1
1
2
2
1
1
1
1
7
1
1
1
5
1
2
2
1
1
1
1
1
5
1
3
1
1
1
1
1
1
副作用の用語は、MedDRA/J version 26.1 SOCおよびPTを使用。
SOCでは,同一症例で同一のSOCを複数発現している場合は1例として集計した。
PTでは,同一症例で同一のPTを複数発現している場合は延べ件数として集計した。
ただし,同一症例の同一PTかつ同一発現日の場合は1件とした。
※:再審査申請時の添付文書の使用上の注意に記載がない副作用
29 / 39
2
3
1
1
1
47
1
4
43
1
1
1
1
7
1
1
3
1
1
1
9
1
1
1
1
1
1
7
1
1
2
2
1
1
1
1
2
2
1
1
2
1
2
1
1
1
1
1
1
1
10
2
1
1
1
1
26
2
2
1
1
11
1
5
2
1
1
1
6
27
3
1
10
2
1
1
1
1
3
1
2
1
14
2
1
1
1
2
3
1
1
1
13
2
1
3
1
1
1
3
7
2
1
3
2
1
2
1
④-3
1
1
1
1
3
1
1
④-2
1
1
1
3
1
④-1
1
1
1
1
④-4
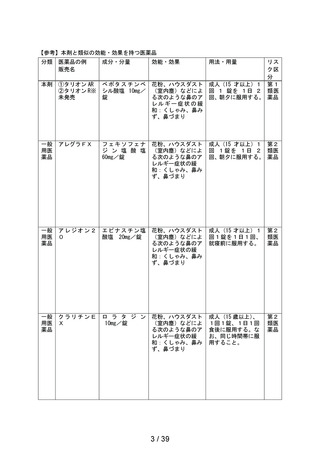
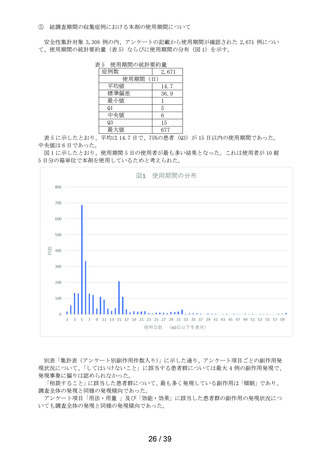
してはいけないこと
副作用発現件数
副作用の種類
感染症および寄生虫症
※ 耳下腺炎
免疫系障害
※ 化学物質アレルギー
精神障害
※ 悪夢
神経系障害
浮動性めまい
頭痛
傾眠
眼障害
※ 眼の異常感
眼部腫脹
※ 眼瞼刺激
心臓障害
動悸
呼吸器、胸郭および縦隔障害
※ 咳嗽
呼吸困難
※ 鼻閉
※ 鼻乾燥
※ くしゃみ
※ 高粘稠性上気道分泌物
胃腸障害
腹部不快感
腹痛
上腹部痛
便秘
下痢
※ 胃腸障害
舌炎
口唇腫脹
悪心
嘔吐
軟便
皮膚および皮下組織障害
薬疹
※ 皮膚乾燥
※ 光線過敏性反応
※ そう痒症
発疹
筋骨格系および結合組織障害
※ 関節痛
腎および尿路障害
※ 頻尿
一般・全身障害および投与部位の状態
※ 異常感
※ 熱感
全身性浮腫
倦怠感
浮腫
発熱
口渇
臨床検査
※ 心拍数増加
※ 体重増加
尿量減少
承認時ま
で
の調査
0
0
0
0
0
0
65
4
3
59
2
1
1
0
0
0
1
0
0
0
1
0
0
11
0
0
6
0
0
1
1
0
4
0
0
6
2
0
1
1
2
0
0
0
0
7
0
1
0
4
0
1
2
0
0
0
0
第1次
第2次
第3次
0
0
0
0
1
1
33
1
1
32
0
0
0
0
1
1
2
0
1
1
0
0
0
6
0
1
0
1
1
0
0
1
2
0
1
1
0
1
0
0
0
1
1
1
1
20
1
0
1
7
1
0
11
2
1
1
0
1
1
1
1
0
0
24
1
4
19
1
0
0
1
0
0
5
1
0
2
1
1
1
6
2
0
1
2
1
0
0
0
0
1
2
1
0
0
0
1
0
0
0
0
0
11
2
0
0
5
0
0
4
1
0
0
1
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
承認後の
①-1
合計
1
1
1
1
1
1
57
2
5
51
1
0
0
1
1
1
7
1
1
3
1
1
1
12
2
1
1
3
2
0
0
1
2
1
3
2
0
1
0
1
0
1
1
1
1
31
3
0
1
12
1
0
15
3
1
1
1
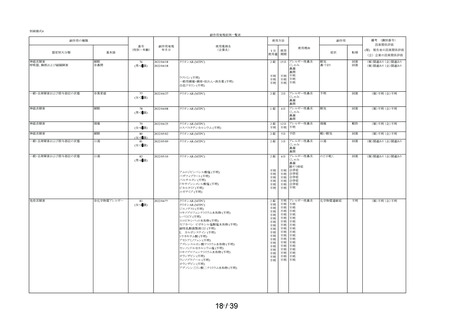
①-2
①-3
①-4
相談すること
①-5
②-1
②-2
②-3
1
1
1
2
1
2
17
1
3
14
用法・用量
②-4
1
1
3
4
3
4
②-5
1
1
17
1
1
16
③-1
1
1
1
1
1
1
45
1
4
41
③-2
効能・効果
③-3
1
1
1
1
1
1
1
4
4
1
8
1
1
6
1
1
4
1
1
1
3
2
1
1
1
1
1
1
2
1
1
1
1
3
1
2
1
1
1
1
1
1
1
1
1
2
2
1
1
1
1
7
1
1
1
5
1
2
2
1
1
1
1
1
5
1
3
1
1
1
1
1
1
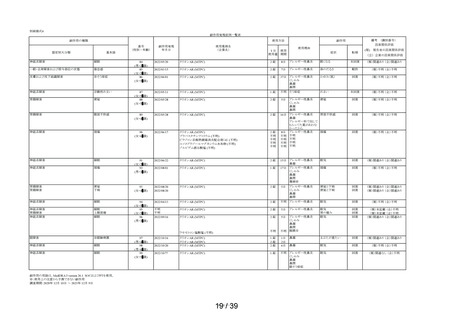
副作用の用語は、MedDRA/J version 26.1 SOCおよびPTを使用。
SOCでは,同一症例で同一のSOCを複数発現している場合は1例として集計した。
PTでは,同一症例で同一のPTを複数発現している場合は延べ件数として集計した。
ただし,同一症例の同一PTかつ同一発現日の場合は1件とした。
※:再審査申請時の添付文書の使用上の注意に記載がない副作用
29 / 39
2
3
1
1
1
47
1
4
43
1
1
1
1
7
1
1
3
1
1
1
9
1
1
1
1
1
1
7
1
1
2
2
1
1
1
1
2
2
1
1
2
1
2
1
1
1
1
1
1
1
10
2
1
1
1
1
26
2
2
1
1
11
1
5
2
1
1
1
6
27
3
1
10
2
1
1
1
1
3
1
2
1
14
2
1
1
1
2
3
1
1
1
13
2
1
3
1
1
1
3
7
2
1
3
2
1
2
1
④-3
1
1
1
1
3
1
1
④-2
1
1
1
3
1
④-1
1
1
1
1
④-4