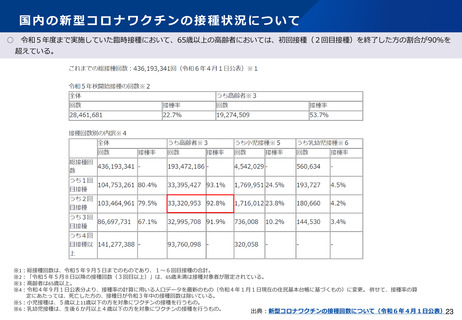
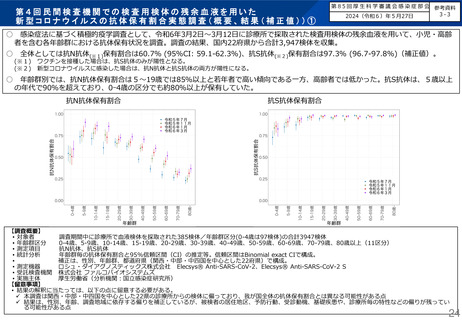
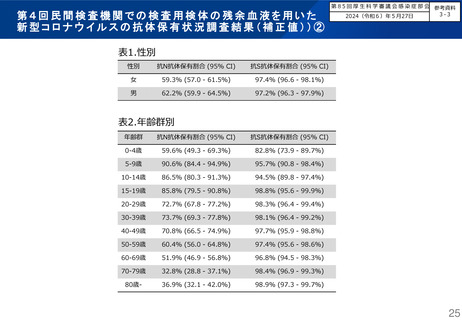
よむ、つかう、まなぶ。
03【資料1】新型コロナワクチンの接種について (20 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_43697.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会(第58回 9/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
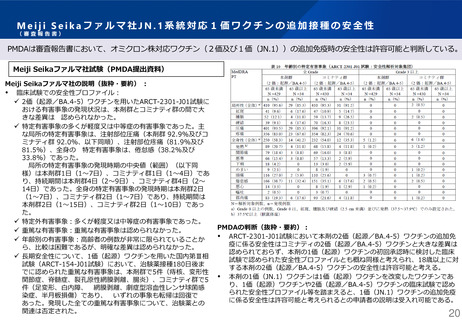
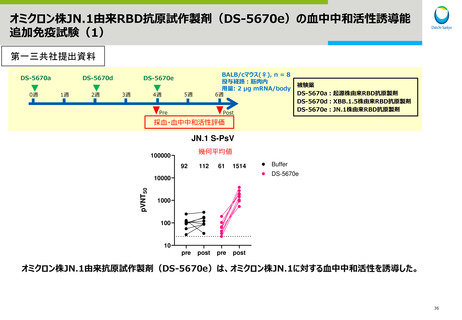
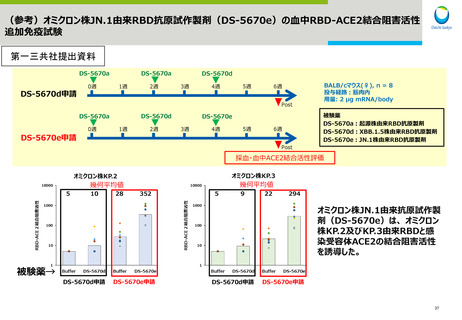
Meiji Seikaファルマ社JN.1系統対応1価ワクチンの追加接種の安全性
(審査報告書)
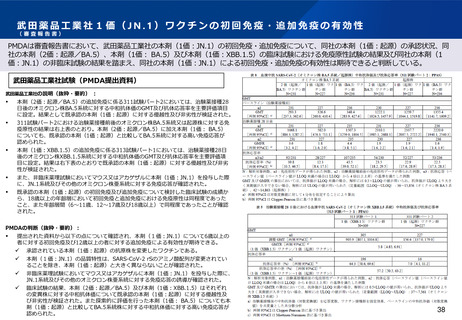
PMDAは審査報告書において、オミクロン株対応ワクチン(2価及び1価(JN.1))の追加免疫時の安全性は許容可能と判断している。
Meiji Seikaファルマ社試験(PMDA提出資料)
Meiji Seikaファルマ社の説明(抜粋・要約) :
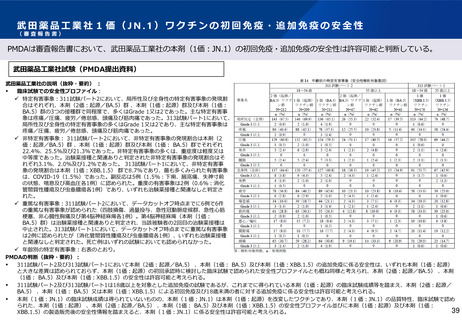
臨床試験での安全性プロファイル:
✓ 2価(起源/BA.4-5)ワクチンを用いたARCT-2301-J01試験に
おける有害事象の発現状況は、本剤群とコミナティ群の間で大
きな差異は 認められなかった。
✓ 特定有害事象の多くが軽度又は中等症の有害事象であった。主
な局所の特定有害事象は、注射部位圧痛(本剤群 92.9%及びコ
ミナティ群 92.0%、以下同順)、注射部位疼痛(81.9%及び
81.5%)、全身の 特定有害事象は、倦怠感(38.2%及び
33.8%)であった。
局所の特定有害事象の発現時期の中央値(範囲)(以下同
様)は本剤群1日(1~7日)、コミナティ群1日(1~4日)であ
り、持続期間は本剤群4日(2~9日)、コミナティ群4日(2~
14日)であった。全身の特定有害事象の発現時期は本剤群2日
(1~7日)、コミナティ群2日(1~7日)であり、持続期間は
本剤群2日(1~15日)、コミナティ群2日(1~10日)であっ
た。
✓ 特定外有害事象:多くが軽度又は中等症の有害事象であった。
✓ 重篤な有害事象:重篤な有害事象は認められなかった。
✓ 年齢別の有害事象:高齢者の例数が非常に限られていることか
ら、比較は困難であるが、明確な差異は認められなかった。
✓ 長期安全性について、1価(起源)ワクチンを用いた国内第Ⅲ相
試験(ARCT-154-J01試験)において、治験薬接種180日後ま
でに認められた重篤な有害事象は、本剤群で5件(痔核、変形性
関節症、脊髄症、裂孔原性網膜剥離、腸炎)、コミナティ群で5
件(足変形、白内障、 網膜剥離、劇症型溶血性レンサ球菌感
染症、半月板損傷)であり、 いずれの事象も転帰は回復で
あった。発現した全ての重篤な有害事象について、治験薬との
関連は否定された。
PMDAの判断(抜粋・要約):
ARCT-2301-J01試験において本剤の2価(起源/BA.4-5)ワクチンの追加免
疫に係る安全性はコミナティの2価(起源/BA.4-5)ワクチンと大きな差異は
認められておらず、本剤の1価(起源)ワクチンの初回承認時に検討した臨床
試験で認められた安全性プロファイルとも概ね同様と考えられ、18歳以上に対
する本剤の2価(起源/BA.4-5)ワクチンの安全性は許容可能と考える。
本剤の1価(JN.1)ワクチンは1価(起源)ワクチンを改変したワクチンであ
り、1価(起源)ワクチンや2価(起源/BA.4-5)ワクチンの臨床試験で認め
られた安全性プロファイル等を踏まえると、1価(JN.1)ワクチンの追加免疫
に係る安全性は許容可能と考えられるとの申請者の説明は受入れ可能である。
20
(審査報告書)
PMDAは審査報告書において、オミクロン株対応ワクチン(2価及び1価(JN.1))の追加免疫時の安全性は許容可能と判断している。
Meiji Seikaファルマ社試験(PMDA提出資料)
Meiji Seikaファルマ社の説明(抜粋・要約) :
臨床試験での安全性プロファイル:
✓ 2価(起源/BA.4-5)ワクチンを用いたARCT-2301-J01試験に
おける有害事象の発現状況は、本剤群とコミナティ群の間で大
きな差異は 認められなかった。
✓ 特定有害事象の多くが軽度又は中等症の有害事象であった。主
な局所の特定有害事象は、注射部位圧痛(本剤群 92.9%及びコ
ミナティ群 92.0%、以下同順)、注射部位疼痛(81.9%及び
81.5%)、全身の 特定有害事象は、倦怠感(38.2%及び
33.8%)であった。
局所の特定有害事象の発現時期の中央値(範囲)(以下同
様)は本剤群1日(1~7日)、コミナティ群1日(1~4日)であ
り、持続期間は本剤群4日(2~9日)、コミナティ群4日(2~
14日)であった。全身の特定有害事象の発現時期は本剤群2日
(1~7日)、コミナティ群2日(1~7日)であり、持続期間は
本剤群2日(1~15日)、コミナティ群2日(1~10日)であっ
た。
✓ 特定外有害事象:多くが軽度又は中等症の有害事象であった。
✓ 重篤な有害事象:重篤な有害事象は認められなかった。
✓ 年齢別の有害事象:高齢者の例数が非常に限られていることか
ら、比較は困難であるが、明確な差異は認められなかった。
✓ 長期安全性について、1価(起源)ワクチンを用いた国内第Ⅲ相
試験(ARCT-154-J01試験)において、治験薬接種180日後ま
でに認められた重篤な有害事象は、本剤群で5件(痔核、変形性
関節症、脊髄症、裂孔原性網膜剥離、腸炎)、コミナティ群で5
件(足変形、白内障、 網膜剥離、劇症型溶血性レンサ球菌感
染症、半月板損傷)であり、 いずれの事象も転帰は回復で
あった。発現した全ての重篤な有害事象について、治験薬との
関連は否定された。
PMDAの判断(抜粋・要約):
ARCT-2301-J01試験において本剤の2価(起源/BA.4-5)ワクチンの追加免
疫に係る安全性はコミナティの2価(起源/BA.4-5)ワクチンと大きな差異は
認められておらず、本剤の1価(起源)ワクチンの初回承認時に検討した臨床
試験で認められた安全性プロファイルとも概ね同様と考えられ、18歳以上に対
する本剤の2価(起源/BA.4-5)ワクチンの安全性は許容可能と考える。
本剤の1価(JN.1)ワクチンは1価(起源)ワクチンを改変したワクチンであ
り、1価(起源)ワクチンや2価(起源/BA.4-5)ワクチンの臨床試験で認め
られた安全性プロファイル等を踏まえると、1価(JN.1)ワクチンの追加免疫
に係る安全性は許容可能と考えられるとの申請者の説明は受入れ可能である。
20