よむ、つかう、まなぶ。
03【資料1】新型コロナワクチンの接種について (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_43697.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会(第58回 9/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
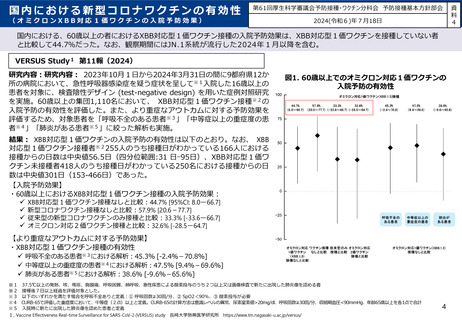
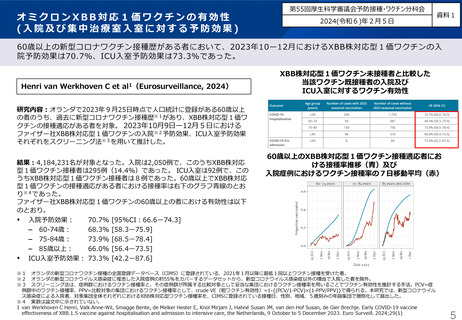
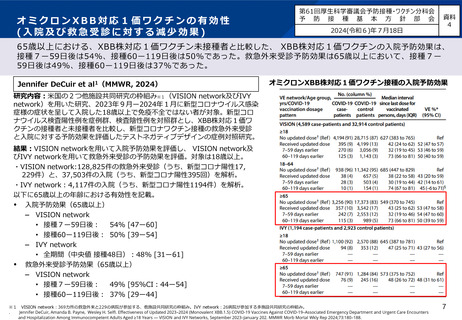
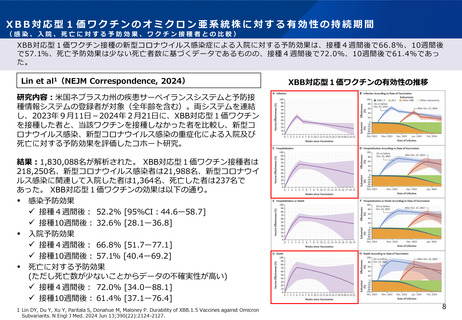
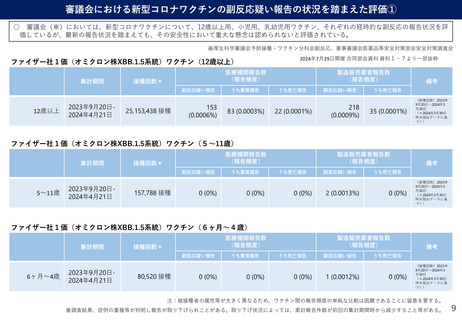
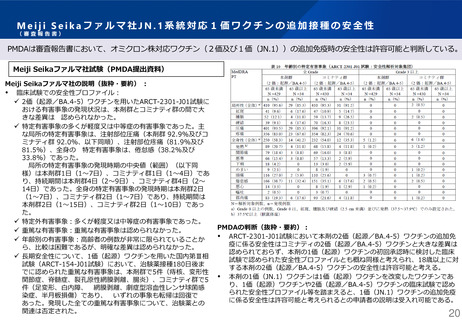
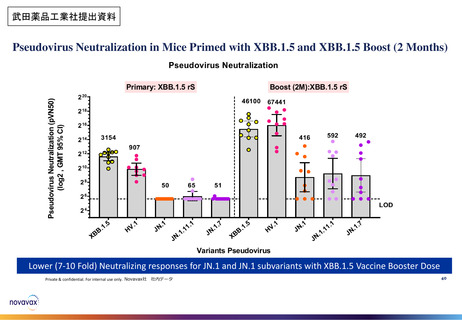
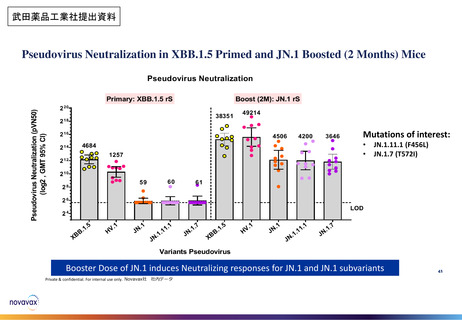
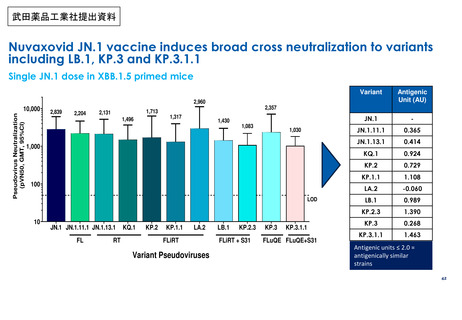
審議会における新型コロナワクチンの副反応疑い報告の状況を踏まえた評価①
○ 審議会(※)においては、新型コロナワクチンについて、12歳以上用、小児用、乳幼児用ワクチン、それぞれの経時的な副反応の報告状況を評
価しているが、最新の報告状況を踏まえても、その安全性において重大な懸念は認められないと評価されている。
※厚生科学審議会予防接種・ワクチン分科会副反応、薬事審議会医薬品等安全対策部会安全対策調査会
2024年7月29日開催 合同部会資料 資料1-7より一部抜粋
ファイザー社1価(オミクロン株XBB.1.5系統)ワクチン(12歳以上)
集計期間
医療機関報告数
(報告頻度)
接種回数*
副反応疑い報告
12歳以上
2023年9月20日2024年4月21日
25,153,438 接種
153
(0.0006%)
うち重篤報告
83 (0.0003%)
製造販売業者報告数
(報告頻度)
うち死亡報告
22 (0.0001%)
副反応疑い報告
218
(0.0009%)
備考
うち死亡報告
35 (0.0001%)
(接種回数)2023年
9月20日~2024年3
月30日
(*2024年3月30日
時点抽出データに基
づく)
ファイザー社1価(オミクロン株XBB.1.5系統)ワクチン(5~11歳)
集計期間
医療機関報告数
(報告頻度)
接種回数*
副反応疑い報告
5~11歳
2023年9月20日2024年4月21日
157,788 接種
0 (0%)
うち重篤報告
0 (0%)
製造販売業者報告数
(報告頻度)
うち死亡報告
0 (0%)
副反応疑い報告
2 (0.0013%)
備考
うち死亡報告
0 (0%)
(接種回数)2023年
9月20日~2024年3
月30日
(*2024年3月30日
時点抽出データに基
づく)
ファイザー社1価(オミクロン株XBB.1.5系統)ワクチン(6ヶ月~4歳)
集計期間
医療機関報告数
(報告頻度)
接種回数*
副反応疑い報告
6ヶ月~4歳
2023年9月20日2024年4月21日
80,520 接種
0 (0%)
うち重篤報告
0 (0%)
製造販売業者報告数
(報告頻度)
うち死亡報告
0 (0%)
副反応疑い報告
1 (0.0012%)
備考
うち死亡報告
0 (0%)
(接種回数)2023年
9月20日~2024年3
月30日
(*2024年3月30日
時点抽出データに基
づく)
注:被接種者の属性等が大きく異なるため、ワクチン間の報告頻度の単純な比較は困難であることに留意を要する。
※調査結果、症例の重複等が判明し報告が取り下げられことがある。取り下げ状況によっては、累計報告件数が前回の集計期間時から減少すること等がある。
9
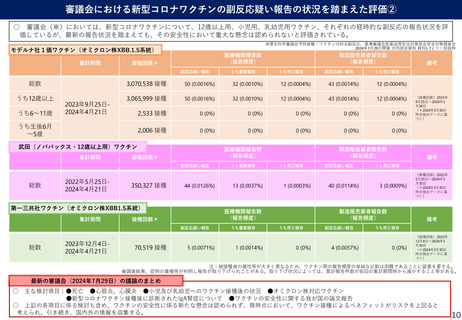
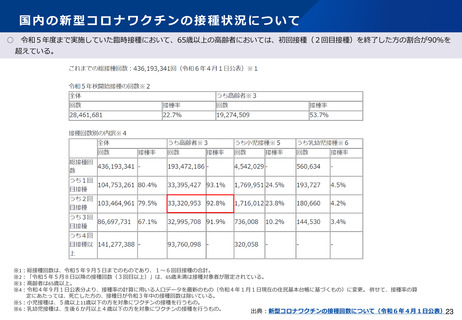
○ 審議会(※)においては、新型コロナワクチンについて、12歳以上用、小児用、乳幼児用ワクチン、それぞれの経時的な副反応の報告状況を評
価しているが、最新の報告状況を踏まえても、その安全性において重大な懸念は認められないと評価されている。
※厚生科学審議会予防接種・ワクチン分科会副反応、薬事審議会医薬品等安全対策部会安全対策調査会
2024年7月29日開催 合同部会資料 資料1-7より一部抜粋
ファイザー社1価(オミクロン株XBB.1.5系統)ワクチン(12歳以上)
集計期間
医療機関報告数
(報告頻度)
接種回数*
副反応疑い報告
12歳以上
2023年9月20日2024年4月21日
25,153,438 接種
153
(0.0006%)
うち重篤報告
83 (0.0003%)
製造販売業者報告数
(報告頻度)
うち死亡報告
22 (0.0001%)
副反応疑い報告
218
(0.0009%)
備考
うち死亡報告
35 (0.0001%)
(接種回数)2023年
9月20日~2024年3
月30日
(*2024年3月30日
時点抽出データに基
づく)
ファイザー社1価(オミクロン株XBB.1.5系統)ワクチン(5~11歳)
集計期間
医療機関報告数
(報告頻度)
接種回数*
副反応疑い報告
5~11歳
2023年9月20日2024年4月21日
157,788 接種
0 (0%)
うち重篤報告
0 (0%)
製造販売業者報告数
(報告頻度)
うち死亡報告
0 (0%)
副反応疑い報告
2 (0.0013%)
備考
うち死亡報告
0 (0%)
(接種回数)2023年
9月20日~2024年3
月30日
(*2024年3月30日
時点抽出データに基
づく)
ファイザー社1価(オミクロン株XBB.1.5系統)ワクチン(6ヶ月~4歳)
集計期間
医療機関報告数
(報告頻度)
接種回数*
副反応疑い報告
6ヶ月~4歳
2023年9月20日2024年4月21日
80,520 接種
0 (0%)
うち重篤報告
0 (0%)
製造販売業者報告数
(報告頻度)
うち死亡報告
0 (0%)
副反応疑い報告
1 (0.0012%)
備考
うち死亡報告
0 (0%)
(接種回数)2023年
9月20日~2024年3
月30日
(*2024年3月30日
時点抽出データに基
づく)
注:被接種者の属性等が大きく異なるため、ワクチン間の報告頻度の単純な比較は困難であることに留意を要する。
※調査結果、症例の重複等が判明し報告が取り下げられことがある。取り下げ状況によっては、累計報告件数が前回の集計期間時から減少すること等がある。
9