よむ、つかう、まなぶ。
03【資料1】新型コロナワクチンの接種について (39 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_43697.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会(第58回 9/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
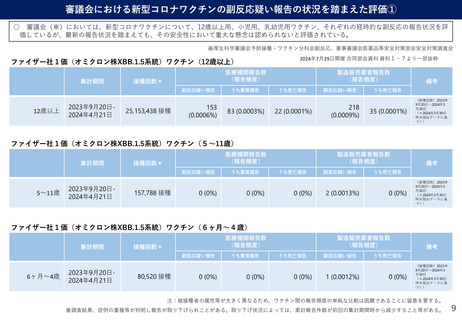
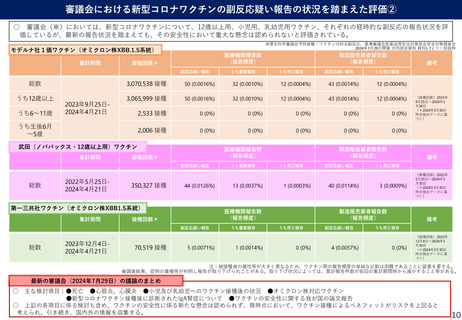
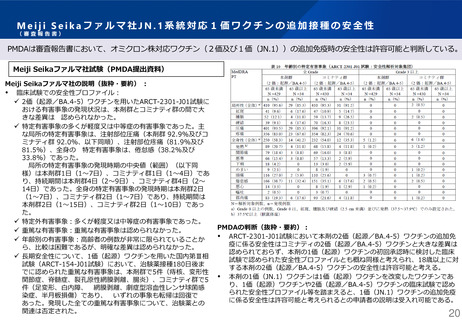
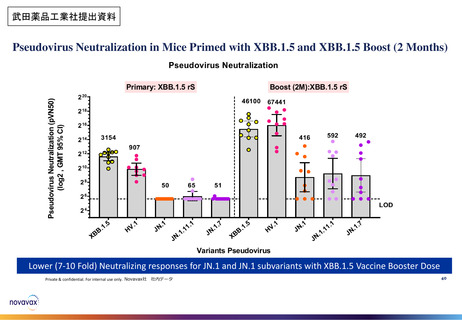
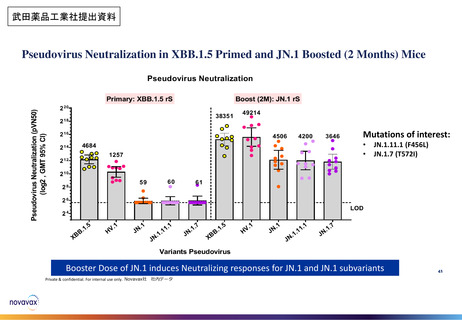
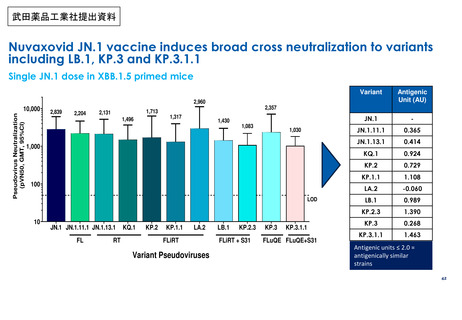
武田薬品工業社1価(JN.1)ワクチンの初回免疫・追加免疫の安全性
(審査報告書)
PMDAは審査報告書において、武田薬品工業社の本剤(1価:JN.1)の初回免疫・追加免疫の安全性は許容可能と判断している。
武田薬品工業社試験(PMDA提出資料)
武田薬品工業社の説明(抜粋・要約) :
臨床試験での安全性プロファイル:
✓ 特定有害事象:311試験パート2において、局所性及び全身性の特定有害事象の発現割
合はそれぞれ、本剤(2価:起源/BA.5)群 、本剤(1価:起源)群及び本剤(1価:
BA.5)群の3つの接種群で同程度で、多くはGrade 1又は2であった。主な特定有害事
象は疼痛/圧痛、疲労/倦怠感、頭痛及び筋肉痛であった。313試験パート1において、
局所性及び全身性の特定有害事象の多くはGrade 1又は2であり、主な特定有害事象は
疼痛/圧痛、疲労/倦怠感、頭痛及び筋肉痛であった。
✓ 非特定有害事象: 311試験パート2において、非特定有害事象の発現割合は本剤(2
価:起源/BA.5)群 、本剤(1価:起源)群及び本剤(1価: BA.5)群でそれぞれ
22.4%、25.5%及び21.3%であった。非特定有害事象の多くは、重症度は軽度又は
中等度であった。治験薬接種と関連ありと判定された非特定有害事象の発現割合はそ
れぞれ3.1%、2.0%及び1.2%であった。 313試験パート1において、非特定有害事
象の発現割合は本剤(1価:XBB.1.5) 群で8.7%であり、最も多くみられた有害事象
は、COVID-19(1.5%)であった。副反応は5例(1.5%:下痢、腋窩痛、失神寸前
の状態、喘息及び高血圧各1例)に認められた。重度の有害事象は2例(0.6%:消化
管間質性腫瘍及び虫垂膿瘍各1例)であり、いずれも治験薬接種と関連なしと判定さ
れた。
✓ 重篤な有害事象:311試験パート2において、データカットオフ時点までに6例で6件
の重篤な有害事象が認められた(四肢損傷、過量投与、急性冠動脈症候群、急性心筋
梗塞、非心臓性胸痛及び第4脳神経麻痺各1例)。第4脳神経麻痺(本剤(1価:
BA.5)群)は治験薬接種と関連ありと判定され、当該被験者の2回目の治験薬接種は
中止された。313試験パート1において、データカットオフ時点までに重篤な有害事象
は2例に認められたが(消化管間質性腫瘍及び虫垂膿瘍各1例)、いずれも治験薬接種
と関連なしと判定された。死亡例はいずれの試験においても認められなかった。
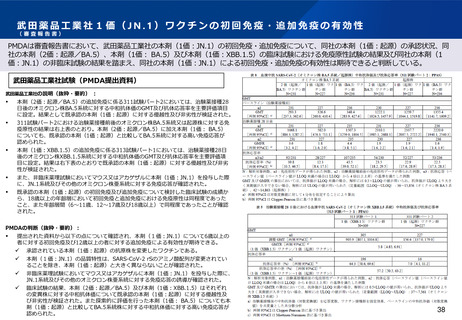
✓ 年齢別の特定有害事象:右表のとおり。
PMDAの判断(抜粋・要約):
311試験パート2及び313試験パート1において本剤(2価:起源/BA.5) 、本剤(1価: BA.5)及び本剤(1価:XBB.1.5)の追加免疫に係る安全性は、いずれも本剤(1価:起源)
と大きな差異は認められておらず、本剤(1価:起源)の初回承認時に検討した臨床試験で認められた安全性プロファイルとも概ね同様と考えられ、本剤(2価:起源/BA.5) 、本剤
(1価: BA.5)及び本剤(1価:XBB.1.5)の安全性は許容可能と考えられる。
311試験パート2及び313試験パート1は18歳以上を対象とした追加免疫の試験であるが、これまでに得られている本剤(1価:起源)の臨床試験成績等を踏まえ、本剤(2価:起源/
BA.5) 、本剤(1価: BA.5)又は本剤(1価:XBB.1.5)による初回免疫及び18歳未満の者に対する追加免疫に係る安全性は許容可能と考えられる。
本剤(1価:JN.1)の臨床試験成績は得られていないものの、本剤(1価:JN.1)は本剤(1価:起源)を改変したワクチンであり、本剤(1価:JN.1)の品質特性、臨床試験で認め
られた、本剤(1価:起源) 、本剤(2価:起源/BA.5) 、本剤(1価: BA.5)及び本剤(1価:XBB.1.5)の安全性プロファイル並びに本剤(1価:起源)及び本剤(1価:
39
XBB.1.5)の製造販売後の安全性情報を踏まえると、本剤(1価:JN.1)に係る安全性は許容可能と考えられる。
(審査報告書)
PMDAは審査報告書において、武田薬品工業社の本剤(1価:JN.1)の初回免疫・追加免疫の安全性は許容可能と判断している。
武田薬品工業社試験(PMDA提出資料)
武田薬品工業社の説明(抜粋・要約) :
臨床試験での安全性プロファイル:
✓ 特定有害事象:311試験パート2において、局所性及び全身性の特定有害事象の発現割
合はそれぞれ、本剤(2価:起源/BA.5)群 、本剤(1価:起源)群及び本剤(1価:
BA.5)群の3つの接種群で同程度で、多くはGrade 1又は2であった。主な特定有害事
象は疼痛/圧痛、疲労/倦怠感、頭痛及び筋肉痛であった。313試験パート1において、
局所性及び全身性の特定有害事象の多くはGrade 1又は2であり、主な特定有害事象は
疼痛/圧痛、疲労/倦怠感、頭痛及び筋肉痛であった。
✓ 非特定有害事象: 311試験パート2において、非特定有害事象の発現割合は本剤(2
価:起源/BA.5)群 、本剤(1価:起源)群及び本剤(1価: BA.5)群でそれぞれ
22.4%、25.5%及び21.3%であった。非特定有害事象の多くは、重症度は軽度又は
中等度であった。治験薬接種と関連ありと判定された非特定有害事象の発現割合はそ
れぞれ3.1%、2.0%及び1.2%であった。 313試験パート1において、非特定有害事
象の発現割合は本剤(1価:XBB.1.5) 群で8.7%であり、最も多くみられた有害事象
は、COVID-19(1.5%)であった。副反応は5例(1.5%:下痢、腋窩痛、失神寸前
の状態、喘息及び高血圧各1例)に認められた。重度の有害事象は2例(0.6%:消化
管間質性腫瘍及び虫垂膿瘍各1例)であり、いずれも治験薬接種と関連なしと判定さ
れた。
✓ 重篤な有害事象:311試験パート2において、データカットオフ時点までに6例で6件
の重篤な有害事象が認められた(四肢損傷、過量投与、急性冠動脈症候群、急性心筋
梗塞、非心臓性胸痛及び第4脳神経麻痺各1例)。第4脳神経麻痺(本剤(1価:
BA.5)群)は治験薬接種と関連ありと判定され、当該被験者の2回目の治験薬接種は
中止された。313試験パート1において、データカットオフ時点までに重篤な有害事象
は2例に認められたが(消化管間質性腫瘍及び虫垂膿瘍各1例)、いずれも治験薬接種
と関連なしと判定された。死亡例はいずれの試験においても認められなかった。
✓ 年齢別の特定有害事象:右表のとおり。
PMDAの判断(抜粋・要約):
311試験パート2及び313試験パート1において本剤(2価:起源/BA.5) 、本剤(1価: BA.5)及び本剤(1価:XBB.1.5)の追加免疫に係る安全性は、いずれも本剤(1価:起源)
と大きな差異は認められておらず、本剤(1価:起源)の初回承認時に検討した臨床試験で認められた安全性プロファイルとも概ね同様と考えられ、本剤(2価:起源/BA.5) 、本剤
(1価: BA.5)及び本剤(1価:XBB.1.5)の安全性は許容可能と考えられる。
311試験パート2及び313試験パート1は18歳以上を対象とした追加免疫の試験であるが、これまでに得られている本剤(1価:起源)の臨床試験成績等を踏まえ、本剤(2価:起源/
BA.5) 、本剤(1価: BA.5)又は本剤(1価:XBB.1.5)による初回免疫及び18歳未満の者に対する追加免疫に係る安全性は許容可能と考えられる。
本剤(1価:JN.1)の臨床試験成績は得られていないものの、本剤(1価:JN.1)は本剤(1価:起源)を改変したワクチンであり、本剤(1価:JN.1)の品質特性、臨床試験で認め
られた、本剤(1価:起源) 、本剤(2価:起源/BA.5) 、本剤(1価: BA.5)及び本剤(1価:XBB.1.5)の安全性プロファイル並びに本剤(1価:起源)及び本剤(1価:
39
XBB.1.5)の製造販売後の安全性情報を踏まえると、本剤(1価:JN.1)に係る安全性は許容可能と考えられる。