よむ、つかう、まなぶ。
03【資料1】新型コロナワクチンの接種について (38 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_43697.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会(第58回 9/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
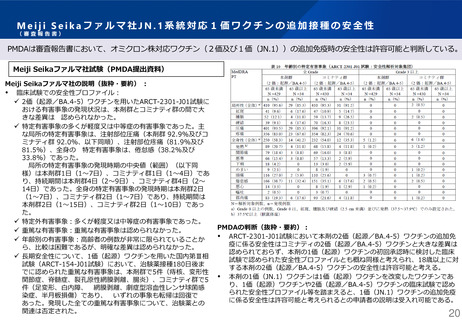
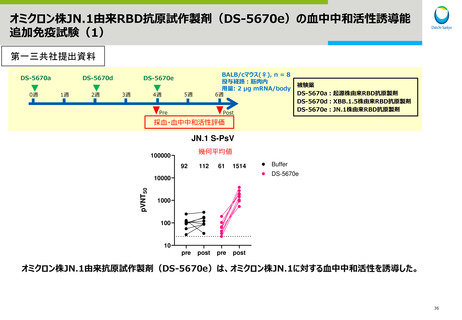
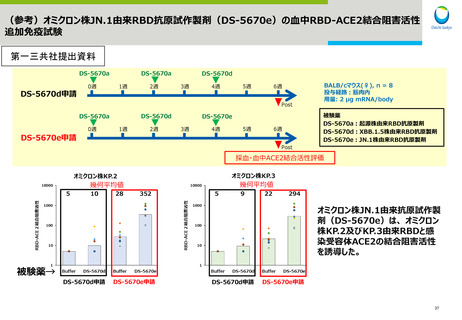
武田薬品工業社1価(JN.1)ワクチンの初回免疫・追加免疫の有効性
(審査報告書)
PMDAは審査報告書において、武田薬品工業社の本剤(1価:JN.1)の初回免疫・追加免疫について、同社の本剤(1価:起源)の承認状況、同
社の本剤(2価:起源/BA.5)、本剤(1価: BA.5)及び本剤(1価:XBB.1.5)の臨床試験における免疫原性試験の結果及び同社の本剤(1
価:JN.1)の非臨床試験の結果を踏まえ、同社の本剤(1価:JN.1)による初回免疫・追加免疫の有効性は期待できると判断している。
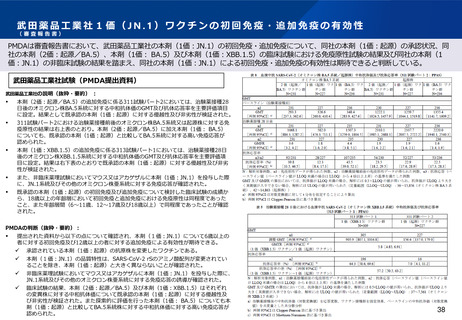
武田薬品工業社試験(PMDA提出資料)
武田薬品工業社の説明(抜粋・要約) :
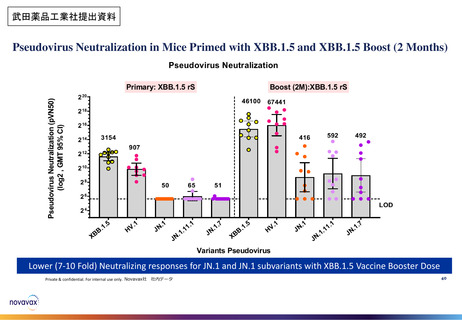
本剤(2価:起源/BA.5)の追加免疫に係る311試験パート2においては、治験薬接種28
日後のオミクロン株BA.5系統に対する中和抗体価のGMT及び抗体応答率を主要評価項目
に設定。結果として既承認の本剤(1価:起源)に対する優越性及び非劣性が検証された。
311試験パート2における治験薬接種前後のオミクロン株BA.5系統又は起源株に対する免
疫原性の結果は右上表のとおり。本剤(2価:起源/BA.5)に加え本剤(1価: BA.5)
についても、既承認の本剤(1価:起源)と比較してBA.5系統に対する高い免疫応答が
認められた。
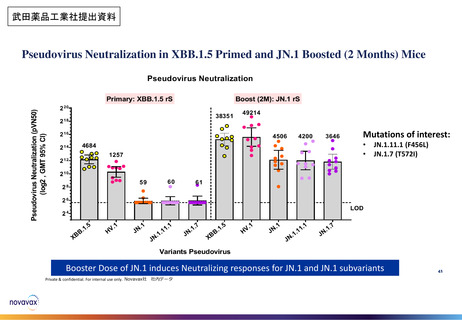
本剤(1価:XBB.1.5)の追加免疫に係る313試験パート1においては、治験薬接種28日
後のオミクロン株XBB.1.5系統に対する中和抗体価のGMT及び抗体応答率を主要評価項
目に設定。結果は右下表のとおりで既承認の本剤(1価:起源)に対する優越性及び非劣
性が検証された。
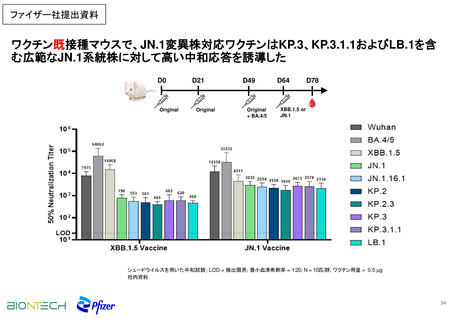
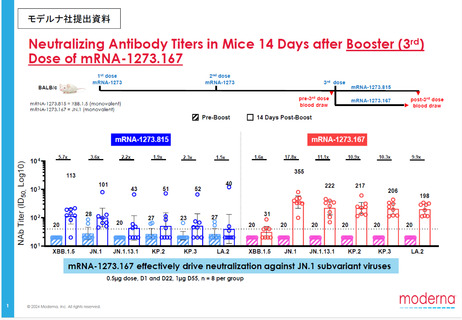
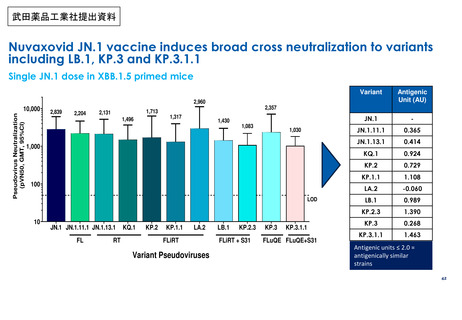
また、非臨床薬理試験においてマウス又はアカゲザルに本剤(1価:JN.1)を投与した際
に、JN.1系統及びその他のオミクロン株亜系統に対する免疫応答が確認された。
既承認の本剤(1価:起源)の初回免疫及び追加免疫について検討した臨床試験の成績か
ら、18歳以上の年齢層において初回免疫と追加免疫における免疫原性は同程度であった
こと、また年齢層間(6~11歳、12~17歳及び18歳以上)で同程度であったことが確認
された。
PMDAの判断(抜粋・要約):
提出された資料から以下の点について確認され、本剤(1価:JN.1)について6歳以上の
者に対する初回免疫及び12歳以上の者に対する追加免疫による有効性が期待できる。
✓
✓
承認されている本剤(1価:起源)の抗原株を変更したワクチンである。
✓
非臨床薬理試験においてマウス又はアカゲザルに本剤(1価:JN.1)を投与した際に、
JN.1系統及びその他のオミクロン株亜系統に対する免疫応答の誘導が確認された。
✓
臨床試験の結果、本剤(2価:起源/BA.5)及び本剤(1価:XBB.1.5)はそれぞれ
の変異株に対する中和抗体価について既承認の本剤(1価:起源)に対する優越性及
び非劣性が検証された。また探索的に評価を行った本剤(1価: BA.5)についても本
剤(1価:起源)と比較してBA.5系統株に対する中和抗体価に対する高い免疫応答が
認められた。
本剤(1価:JN.1)の品質特性は、SARS-CoV-2 rSのアミノ酸配列が変更されてい
ることを除き、本剤(1価:起源)と大きく異ならないことが確認された。
38
(審査報告書)
PMDAは審査報告書において、武田薬品工業社の本剤(1価:JN.1)の初回免疫・追加免疫について、同社の本剤(1価:起源)の承認状況、同
社の本剤(2価:起源/BA.5)、本剤(1価: BA.5)及び本剤(1価:XBB.1.5)の臨床試験における免疫原性試験の結果及び同社の本剤(1
価:JN.1)の非臨床試験の結果を踏まえ、同社の本剤(1価:JN.1)による初回免疫・追加免疫の有効性は期待できると判断している。
武田薬品工業社試験(PMDA提出資料)
武田薬品工業社の説明(抜粋・要約) :
本剤(2価:起源/BA.5)の追加免疫に係る311試験パート2においては、治験薬接種28
日後のオミクロン株BA.5系統に対する中和抗体価のGMT及び抗体応答率を主要評価項目
に設定。結果として既承認の本剤(1価:起源)に対する優越性及び非劣性が検証された。
311試験パート2における治験薬接種前後のオミクロン株BA.5系統又は起源株に対する免
疫原性の結果は右上表のとおり。本剤(2価:起源/BA.5)に加え本剤(1価: BA.5)
についても、既承認の本剤(1価:起源)と比較してBA.5系統に対する高い免疫応答が
認められた。
本剤(1価:XBB.1.5)の追加免疫に係る313試験パート1においては、治験薬接種28日
後のオミクロン株XBB.1.5系統に対する中和抗体価のGMT及び抗体応答率を主要評価項
目に設定。結果は右下表のとおりで既承認の本剤(1価:起源)に対する優越性及び非劣
性が検証された。
また、非臨床薬理試験においてマウス又はアカゲザルに本剤(1価:JN.1)を投与した際
に、JN.1系統及びその他のオミクロン株亜系統に対する免疫応答が確認された。
既承認の本剤(1価:起源)の初回免疫及び追加免疫について検討した臨床試験の成績か
ら、18歳以上の年齢層において初回免疫と追加免疫における免疫原性は同程度であった
こと、また年齢層間(6~11歳、12~17歳及び18歳以上)で同程度であったことが確認
された。
PMDAの判断(抜粋・要約):
提出された資料から以下の点について確認され、本剤(1価:JN.1)について6歳以上の
者に対する初回免疫及び12歳以上の者に対する追加免疫による有効性が期待できる。
✓
✓
承認されている本剤(1価:起源)の抗原株を変更したワクチンである。
✓
非臨床薬理試験においてマウス又はアカゲザルに本剤(1価:JN.1)を投与した際に、
JN.1系統及びその他のオミクロン株亜系統に対する免疫応答の誘導が確認された。
✓
臨床試験の結果、本剤(2価:起源/BA.5)及び本剤(1価:XBB.1.5)はそれぞれ
の変異株に対する中和抗体価について既承認の本剤(1価:起源)に対する優越性及
び非劣性が検証された。また探索的に評価を行った本剤(1価: BA.5)についても本
剤(1価:起源)と比較してBA.5系統株に対する中和抗体価に対する高い免疫応答が
認められた。
本剤(1価:JN.1)の品質特性は、SARS-CoV-2 rSのアミノ酸配列が変更されてい
ることを除き、本剤(1価:起源)と大きく異ならないことが確認された。
38