よむ、つかう、まなぶ。
総-3-1最適使用推進ガイドライン ドナネマブ(遺伝子組換え) (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_45183.html |
| 出典情報 | 中央社会保険医療協議会 総会(第598回 11/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
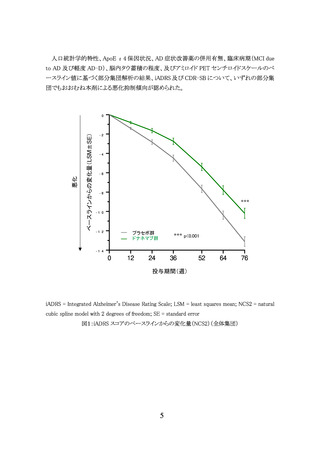
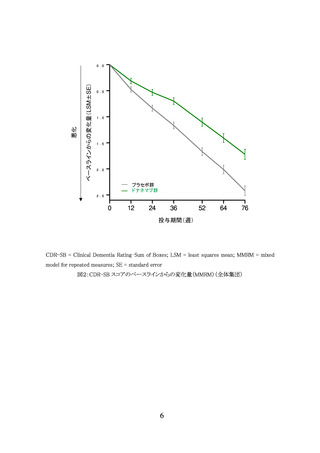
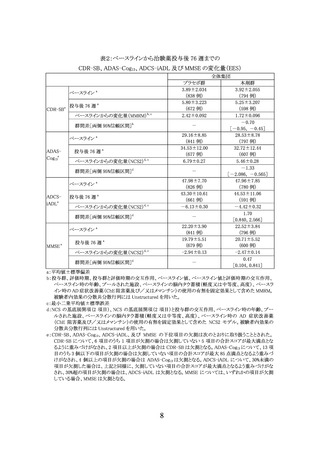
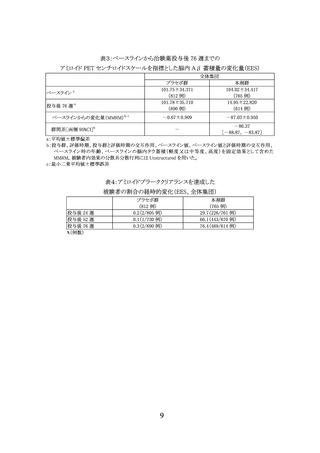
3.臨床成績
製造販売承認時に評価を行った主な臨床試験の成績を示す。
(1) 国際共同第Ⅲ相試験(AACI 試験)
【試験の概要】
本剤の有効性についてプラセボに対する優越性を検証する目的で、軽度から高度の脳内
タウ蓄積が認められる早期 AD 患者 1736 例(うち日本人 88 例)を対象としたプラセボ対照無
作為化二重盲検比較試験が国内外 277 施設で実施された。
本試験は導入期間(詳細なスクリーニング期間の前に随時)、詳細なスクリーニング期間(最長7
週間)、76 週間の二重盲検投与期間、78 週間の継続投与期間、最長 44 週間の追跡調査期間か
ら構成された。 二重盲検投与期間中は、プラセボ又は本剤 1400 mg(ただし、最初の3回は
700 mg)を4週間に1回静脈内投与することとされ、治験薬投与 24 及び 52 週時のフロルベタピ
ル(18F)又は florbetaben(18F)を用いたアミロイド陽電子放出断層撮影(PET)検査においてアミ
ロイドプラークの減少が投与完了の基準1)を満たした場合、二重盲検下で本剤からプラセボへ
切り替えることとされた。
[主な選択基準]
以下を満たす 60 歳以上 85 歳以下の早期 AD 患者
記憶障害が6か月以上にわたって徐々に進行していることが本人又はスタディパートナー
2)
から報告されている
導入期間又はスクリーニング時の Mini-Mental State Examination(MMSE)スコアが 20 以
上 28 以下である
フロルベタピル(18F)又は florbetaben(18F)3)を用いたアミロイド PET 検査により脳内にアミロ
イドプラークが認められる
Flortaucipir(18F)を用いたタウ PET 検査により軽度から高度4)の脳内タウ蓄積が認められ
る
スクリーニング時の核磁気共鳴画像(MRI)検査において、下記の所見が認められていな
い
➢
アミロイド関連画像異常-浮腫/滲出液貯留
1)いずれか 1 回の測定で 11 センチロイド未満、又は連続する 2 回の測定で 11 以上 25 センチロイド未満。
2)治験参加のために同意説明文書を提出し、患者と 1 週間に 10 時間以上連絡を取れる状態にあり、患者の
試験来院に付き添うことができる又は指定した時間に電話で連絡が取れる者とされた。
3)日本ではフロルベタピル(18F)のみが用いられた。
4)脳内タウ蓄積が軽度又は中等度:視覚読影による蓄積部位のパターンが中等度の AD(JAMA Neurol 2020;
77: 829-39)に相当し SUVr 1.10 以上 1.46 以下、又は視覚読影による蓄積部位のパターンが高度の AD に
相当し SUVr 1.46 以下
脳内タウ蓄積が高度:視覚読影による蓄積部位のパターンが中等度の AD 又は高度の AD に相当し SUVr
1.46 以上
3
製造販売承認時に評価を行った主な臨床試験の成績を示す。
(1) 国際共同第Ⅲ相試験(AACI 試験)
【試験の概要】
本剤の有効性についてプラセボに対する優越性を検証する目的で、軽度から高度の脳内
タウ蓄積が認められる早期 AD 患者 1736 例(うち日本人 88 例)を対象としたプラセボ対照無
作為化二重盲検比較試験が国内外 277 施設で実施された。
本試験は導入期間(詳細なスクリーニング期間の前に随時)、詳細なスクリーニング期間(最長7
週間)、76 週間の二重盲検投与期間、78 週間の継続投与期間、最長 44 週間の追跡調査期間か
ら構成された。 二重盲検投与期間中は、プラセボ又は本剤 1400 mg(ただし、最初の3回は
700 mg)を4週間に1回静脈内投与することとされ、治験薬投与 24 及び 52 週時のフロルベタピ
ル(18F)又は florbetaben(18F)を用いたアミロイド陽電子放出断層撮影(PET)検査においてアミ
ロイドプラークの減少が投与完了の基準1)を満たした場合、二重盲検下で本剤からプラセボへ
切り替えることとされた。
[主な選択基準]
以下を満たす 60 歳以上 85 歳以下の早期 AD 患者
記憶障害が6か月以上にわたって徐々に進行していることが本人又はスタディパートナー
2)
から報告されている
導入期間又はスクリーニング時の Mini-Mental State Examination(MMSE)スコアが 20 以
上 28 以下である
フロルベタピル(18F)又は florbetaben(18F)3)を用いたアミロイド PET 検査により脳内にアミロ
イドプラークが認められる
Flortaucipir(18F)を用いたタウ PET 検査により軽度から高度4)の脳内タウ蓄積が認められ
る
スクリーニング時の核磁気共鳴画像(MRI)検査において、下記の所見が認められていな
い
➢
アミロイド関連画像異常-浮腫/滲出液貯留
1)いずれか 1 回の測定で 11 センチロイド未満、又は連続する 2 回の測定で 11 以上 25 センチロイド未満。
2)治験参加のために同意説明文書を提出し、患者と 1 週間に 10 時間以上連絡を取れる状態にあり、患者の
試験来院に付き添うことができる又は指定した時間に電話で連絡が取れる者とされた。
3)日本ではフロルベタピル(18F)のみが用いられた。
4)脳内タウ蓄積が軽度又は中等度:視覚読影による蓄積部位のパターンが中等度の AD(JAMA Neurol 2020;
77: 829-39)に相当し SUVr 1.10 以上 1.46 以下、又は視覚読影による蓄積部位のパターンが高度の AD に
相当し SUVr 1.46 以下
脳内タウ蓄積が高度:視覚読影による蓄積部位のパターンが中等度の AD 又は高度の AD に相当し SUVr
1.46 以上
3