よむ、つかう、まなぶ。
総-2参考3 (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_46580.html |
| 出典情報 | 中央社会保険医療協議会 総会(第599回 12/11)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
3.臨床成績
既存治療で効果不十分な AD の承認時に評価を行った主な臨床試験の成績を示す。
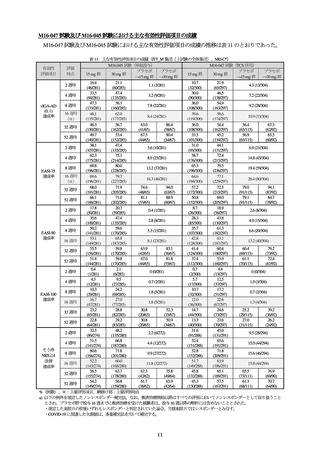
国際共同第Ⅲ相試験(M16-047 試験1))
:ステロイド外用薬併用試験
【試験の概要】
ステロイド外用薬(以下、
「TCS」
)若しくはカルシニューリン阻害外用薬(以下、
「TCI」
)で効果不十分、
又は AD に対する全身療法の治療歴がある AD 患者(主試験:目標例数 810 例〔各群 270 例〕
、青少年副試
験:12 歳以上 18 歳未満の小児 AD 患者の目標例数 180 例2)〔各群 60 例〕
)を対象に、TCS 併用下でのプラ
セボに対する本剤の優越性及び安全性を検討するため、プラセボ対照無作為化二重盲検並行群間比較試験
が日本、米国、カナダ等の 22 の国又は地域3)で実施された。
本試験は 2 期(二重盲検期:投与 16 週まで、継続投与期:投与 16 週以降 260 週まで)から構成され、
用法・用量は、二重盲検期では本剤 15 mg、30 mg 又はプラセボを、継続投与期では、二重盲検期に本剤が
投与された被験者は二重盲検期と同じ用量の本剤を、二重盲検期にプラセボが投与された被験者は本剤
15 mg 又は 30 mg をそれぞれ 1 日 1 回経口投与することと設定された。ベースライン時の 7 日以上前から
投与 52 週まで保湿外用薬を 1 日 2 回併用することとされ、ベースライン時より TCS 治療を開始し、病勢
が収束した場合は中止することとされた4)。投与 4 週以降に症状の改善が不十分な場合5)は救済治療6)が許
容された。また、投与 52 週以降は医師の判断で AD に対する外用療法を追加することが可能とされ、そ
の場合、当該外用療法は救済治療とはみなされず、AD に対する全身療法の追加のみを救済治療として取
り扱うこととされた。
投与 16 週時の医師による皮膚病変の全般評価スコア(vIGA-AD スコア)が 1 以下かつ 2 以上減少した
被験者の割合(vIGA-AD (0, 1)達成率)
、及び皮膚病変の面積・重症度をスコア化した EASI スコアが 75%
以上改善した被験者の割合(EASI-75 達成率)が co-primary endpoint とされた。
対象となる患者は、12 歳以上の AD 患者で、以下の基準を満たすこととされた。
(主な選択基準)
➢
Hanifin & Rajka の AD 診断基準に基づき AD と診断され、3 年以上前に発症
➢
EASI スコア 16 以上、vIGA-AD スコア 3 以上、体表面積に占める AD 病変の割合 10%以上、及び無
作為化直前 7 日間におけるそう痒点数評価スケール(NRS)スコアの平均値 4 以上
➢
TCS 若しくは TCI で効果不十分又は AD に対する全身療法の治療歴を有する旨の 6 カ月以内の記録
がある
➢
12 歳以上 18 歳未満の場合は体重が 40 kg 以上7)
成人及び 12 歳以上の小児 AD 患者を対象とした主試験並びに 12 歳以上の小児 AD 患者を対象とした青少年副試験(12 歳以上 18 歳未満の
小児における本剤の安全性及び有効性を更に検討するためにあらかじめ計画された、主試験と同一デザインの試験)から成る。
2)
主試験と青少年副試験の 12 歳以上 18 歳未満の被験者の合計例数が 180 例になるよう、主試験の目標例数到達後に 12 歳以上 18 歳未満の AD
患者が青少年副試験に組み入れられた。
3)
このうち 17 の国又は地域で 12 歳以上 18 歳未満の AD 患者が組み入れられた。なお、本邦も本試験に参加し、成人 AD 患者の登録はみられ
たものの、小児 AD 患者については、症例登録には至らなかった。
4)
皮膚炎の活動性が高い部位に Medium potency(日本の分類ではストロングクラス程度に相当)の TCS を 1 日 1 回使用し、皮疹が消失若しく
はほぼ消失した場合又は3 週間経過した場合、Low potency(日本の分類ではミディアムクラス程度に相当)の TCS へ切り換えて 1 日 1 回 7
日間使用し、その後 TCS を中止することとされた。皮膚の薄い部位(顔面、頸頚部、間擦部及び鼠鼡径部)又は Medium potency の TCS が
安全でないと考えられる部位(皮膚萎縮部位等)には Medium potency の TCS の代わりに Low potency の TCS 又は TCI を使用することとさ
れ、漸減した上で中止することとされた。
5)
医師により救済治療が必要と判断され、かつ次の基準を満たす場合とされた。投与 4 週以降~24 週まで:2 回の連続する規定来院時に EASI50 非達成、投与 24 週以降:来院時に EASI-50 非達成
6)
High potency 若しくは Very high potency(日本の分類ではベリーストロングクラス~ストロンゲストクラス程度に相当)の TCS 又はその他の
AD に対する外用薬より開始することとされ、7 日以上外用療法を実施しても効果不十分な場合には、全身療法の実施が許容された。
7)
12 歳以上の小児 AD 患者に対する本剤の承認用法・用量における体重の下限は 30 kg である(
「1. はじめに」
「5. 投与対象となる患者」参照)
。
1)
4
既存治療で効果不十分な AD の承認時に評価を行った主な臨床試験の成績を示す。
国際共同第Ⅲ相試験(M16-047 試験1))
:ステロイド外用薬併用試験
【試験の概要】
ステロイド外用薬(以下、
「TCS」
)若しくはカルシニューリン阻害外用薬(以下、
「TCI」
)で効果不十分、
又は AD に対する全身療法の治療歴がある AD 患者(主試験:目標例数 810 例〔各群 270 例〕
、青少年副試
験:12 歳以上 18 歳未満の小児 AD 患者の目標例数 180 例2)〔各群 60 例〕
)を対象に、TCS 併用下でのプラ
セボに対する本剤の優越性及び安全性を検討するため、プラセボ対照無作為化二重盲検並行群間比較試験
が日本、米国、カナダ等の 22 の国又は地域3)で実施された。
本試験は 2 期(二重盲検期:投与 16 週まで、継続投与期:投与 16 週以降 260 週まで)から構成され、
用法・用量は、二重盲検期では本剤 15 mg、30 mg 又はプラセボを、継続投与期では、二重盲検期に本剤が
投与された被験者は二重盲検期と同じ用量の本剤を、二重盲検期にプラセボが投与された被験者は本剤
15 mg 又は 30 mg をそれぞれ 1 日 1 回経口投与することと設定された。ベースライン時の 7 日以上前から
投与 52 週まで保湿外用薬を 1 日 2 回併用することとされ、ベースライン時より TCS 治療を開始し、病勢
が収束した場合は中止することとされた4)。投与 4 週以降に症状の改善が不十分な場合5)は救済治療6)が許
容された。また、投与 52 週以降は医師の判断で AD に対する外用療法を追加することが可能とされ、そ
の場合、当該外用療法は救済治療とはみなされず、AD に対する全身療法の追加のみを救済治療として取
り扱うこととされた。
投与 16 週時の医師による皮膚病変の全般評価スコア(vIGA-AD スコア)が 1 以下かつ 2 以上減少した
被験者の割合(vIGA-AD (0, 1)達成率)
、及び皮膚病変の面積・重症度をスコア化した EASI スコアが 75%
以上改善した被験者の割合(EASI-75 達成率)が co-primary endpoint とされた。
対象となる患者は、12 歳以上の AD 患者で、以下の基準を満たすこととされた。
(主な選択基準)
➢
Hanifin & Rajka の AD 診断基準に基づき AD と診断され、3 年以上前に発症
➢
EASI スコア 16 以上、vIGA-AD スコア 3 以上、体表面積に占める AD 病変の割合 10%以上、及び無
作為化直前 7 日間におけるそう痒点数評価スケール(NRS)スコアの平均値 4 以上
➢
TCS 若しくは TCI で効果不十分又は AD に対する全身療法の治療歴を有する旨の 6 カ月以内の記録
がある
➢
12 歳以上 18 歳未満の場合は体重が 40 kg 以上7)
成人及び 12 歳以上の小児 AD 患者を対象とした主試験並びに 12 歳以上の小児 AD 患者を対象とした青少年副試験(12 歳以上 18 歳未満の
小児における本剤の安全性及び有効性を更に検討するためにあらかじめ計画された、主試験と同一デザインの試験)から成る。
2)
主試験と青少年副試験の 12 歳以上 18 歳未満の被験者の合計例数が 180 例になるよう、主試験の目標例数到達後に 12 歳以上 18 歳未満の AD
患者が青少年副試験に組み入れられた。
3)
このうち 17 の国又は地域で 12 歳以上 18 歳未満の AD 患者が組み入れられた。なお、本邦も本試験に参加し、成人 AD 患者の登録はみられ
たものの、小児 AD 患者については、症例登録には至らなかった。
4)
皮膚炎の活動性が高い部位に Medium potency(日本の分類ではストロングクラス程度に相当)の TCS を 1 日 1 回使用し、皮疹が消失若しく
はほぼ消失した場合又は3 週間経過した場合、Low potency(日本の分類ではミディアムクラス程度に相当)の TCS へ切り換えて 1 日 1 回 7
日間使用し、その後 TCS を中止することとされた。皮膚の薄い部位(顔面、頸頚部、間擦部及び鼠鼡径部)又は Medium potency の TCS が
安全でないと考えられる部位(皮膚萎縮部位等)には Medium potency の TCS の代わりに Low potency の TCS 又は TCI を使用することとさ
れ、漸減した上で中止することとされた。
5)
医師により救済治療が必要と判断され、かつ次の基準を満たす場合とされた。投与 4 週以降~24 週まで:2 回の連続する規定来院時に EASI50 非達成、投与 24 週以降:来院時に EASI-50 非達成
6)
High potency 若しくは Very high potency(日本の分類ではベリーストロングクラス~ストロンゲストクラス程度に相当)の TCS 又はその他の
AD に対する外用薬より開始することとされ、7 日以上外用療法を実施しても効果不十分な場合には、全身療法の実施が許容された。
7)
12 歳以上の小児 AD 患者に対する本剤の承認用法・用量における体重の下限は 30 kg である(
「1. はじめに」
「5. 投与対象となる患者」参照)
。
1)
4